 |
Обычно увеличение концентрации субстрата увеличивает скорость реакции фермента. Однако на некоторые ферменты большие количества субстрата могут оказывать противоположный эффект и фактически замедлять реакцию. Примером может служить инвертаза или - фруктофуранозидаза (КФ.3.2.1.26), который катализирует реакцию гидролиза
Рис 2-13. Влияние концентрации субстрата на скорость реакции
сахарозы на составляющие моносахариды глюкозу и фруктозу.
Предполагают, что причиной торможения может быть попытка двух молекул субстрата одновременно связаться с активным центром и пока молекулы субстрата связаны с активным центром фермент неактивен. Для такого связывания необходимо, чтобы вторая молекула субстрата «вставилась» в активный центр быстро вслед за первой, пока последняя не успела занять полноценную позицию для катализа. Поскольку столкновения между ферментом и субстратом полностью случайны, такое может случиться только при высоких концентрациях субстрата, когда частота случайных столкновений увеличивается, и явление торможения может быть замечено исследователем. Пример такого влияния показан на рис 2-13.
 |
Так как торможение субстратом происходит при высоком уровне субстрата, начальная часть (низкая концентрация субстрата) этого графика идентична таковой для нормального
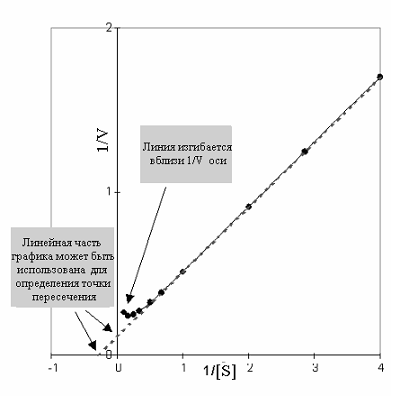
Рис 2-14. График Лаинуивера-Берка по данным рис 2-13.
фермента. При высоком уровне субстрата кривая снижается, что свидетельствует о торможении скорости реакции.
Так как фермент не следует предписаниям уравнения Михаэлиса и Ментен (не прямоугольная гипербола), график Лайнуивера Берка также не линеен. Поэтому вблизи оси 1/V на участке высокой концентрации субстрата, линия изгибается вверх, указывая на снижение скорости. Продолжая линейную часть графика до пересечения с осями можно определить основные кинетические параметры обычным способом.
Табл 2- 5. Эффекты обратимых ингибиторов на кинетические константы
| Тип ингибитора | Эффект |
| Конкурентный (I связывается только к E) | Увеличение Km, а Vmax остается без изменений |
| Неконкурентный (I связывается только с ES) | Снижена Vmax и Km Отношение Vmax.Km остается без изменений |
| Смешанный неконкурентный (I связывается с E или ES) | Снижается Vmax. Km остается без изменений |
Регуляция активности ферментов путем химической модификации: Реакции ограниченного протеолиза, аденилирования, рибозилирования, ацетилирования, фосфорилирования (роль гормонов, АЦ-комплекса, цАМФ, цГМФ, ионов Ca).
Активность фермента можно изменить путем ковалентной модификации его структуры.
Ковалентная модификация структуры ферментов может быть обратимой и необратимой.
А. Необратимые изменения активности фермента. Существует большое число реакций, катализируемых протеолитическими ферментами. Как правило, такие ферменты образуются в форме неактивных предшественников (проферментов), которые затем активируются путем действия других протеаз. Схеме активирования химотрипсина показана ниже на рис.2-15.
 |
Рис 2-15. Схема протеолиза молекулы химотрипсиногена. Вначале под влиянием трипсина происходит отщепление полипептида из 15 аминокислот с образованием активного -химотрипсина, который путем аутокатализа превращается в -химотрипсин
Ниже в таблице приводятся примеры других ферментов, которые подвергаются активируются путем протеолиза
| Фермент | Профермент | Место образования |
| Трипсин | трипсиноген | поджелудочная железа |
| Химотрипсин | химотрипсиноген | поджелудочная железа |
| Эластаза | проэластаза | поджелудочная железа |
| Карбоксипептидаза | прокарбоксипептидаза | поджелудочная железа |
| Фосфолипаза А2 | профосфолипаза А2 | поджелудочная железа |
| Пепсин | пепсиноген | желудок |
| Тромбин | протромбин | свертывание крови |
| C1r | C1r- | комплемент |
| Хитин синтаза | зимоген | стенка клеток дрожжей |
В качестве примера можно рассмотреть ферменты поджелудочной железы. Эти ферменты синтезируются в форме проферментов клетками поджелудочной железы и сохраняются в них в составе гранул проферментов. Высвобождение проферментов регулируется гормонами холецистокинином, панкрезимином и секретином. Усвоение белков требует скоординированного действия различных ферментов. Трипсиноген активируется энтеропептидазой выделяемой клетками щеточной каймы кишечника. Энтеропептидаза катализирует удаление гексапептида (Вал Асп Асп Асп Асп Лиз) от N конца трипсиногена. Задача системы регуляции в данном случае обеспечить активирование фермента в месте его действия. Если активирование произойдет в месте синтеза, то это повлечет за собой разрушение самой железы (острый панкреатит). Небольшое количество энтеропептидазы, необходимое для активирования трипсиногена обеспечит последующее усиление (амплификацию) сигнала за счет образования больших количеств активного трипсина, который в свою очередь активирует другие протеазы кишечника. Такие цепные реакции усиления характерны для многих протеолитических систем организма (свертывание крови, система комплемента и т.д.) Процесс останавливается путем протеолиза самих ферментов Средняя ежедневная продукция короткоживущих гидролитических ферментов поджелудочной железой - около 10 г. Протеолитические ферменты широко распространены в клетках и это могло создать значительные проблемы, если бы не специальные белковые игибиторы, присутствующие в тканях и крови.
Б. Обратимые изменения активности фермента путем ковалентной модификации.
Фосфорилирование ферментов (рис 2-16) - одна из наиболее популярных реакций, позволяющая при присоединении остатка фосфорной кислоты изменить конформацию фермента и перевести фермент из активного состояние в неактивное или наоборот. Этот механизм ковалентной модификации обеспечивается киназами (присоединение остатков фосфорной кислоты за счет АТФ) и фосфатазами (гидролитическое удаление остатков фосфорной кислоты).
Более подробно об этих механизмах будет рассказано в разделах, посвященных механизму действия гормонов.
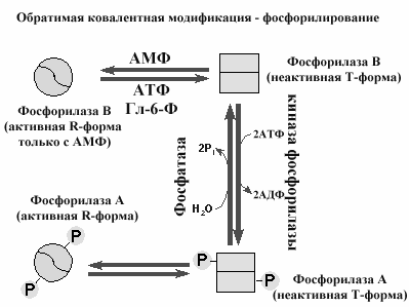 |
Рис 2-16. Обратимая ковалентная модификация путем фосфорилирования (киназа фосфорилазы) и дефосфорилирования (фосфатаза) фосфорилазы.






