Предложены две основные модели, описывающие механизмы аллостерии: согласованный механизм аллостерических взаимодействий или симметричная модель, предложенная Жаком Моно, Джефри Уайменом и Жаном-Пьером Шанже в 1965 году, и последовательная модель, предложенная Даниелом Кошландом. В основном эти модели лишь крайние формы представлений о механизме работы аллостеричеких ферментов.. Главное различие между ними в том, что симметричная модель представляет мультимерный аллостерический фермент как объединение нескольких субъединиц, согласованно изменяющих свою конформацию, в то время как модель Кошланда учитывает сосуществование смешанных, или гибридных молекул, субъединицы которых могут находится в различных конформационных состояниях.
Симметричная модель. Симметричная модель аллостерии является простым и изящным объяснением положительной субстратной кооперативности и влияния аллостерических эффекторов. Она основана на идее, что аллостерический фермент состоит из ряда субъединиц, которые могут существовать в двух различных конформациях. Их обозначают как расслабленное или R-состояние, и напряженное или T-состояние.
 Все субъединицы данной молекулы фермента должны иметь одну и ту же конформацию. Другими словами, молекула фермента должна состоять полностью из R субъединиц или T субъединиц, и не может содержать смесь этих форм. В растворе эти две формы находятся в равновесии. Поскольку смесей типов субъединиц в индивидуальном белке невозможны, в растворе возникает простое равновесие между белками, состоящими полностью из R и T субъединиц.
Все субъединицы данной молекулы фермента должны иметь одну и ту же конформацию. Другими словами, молекула фермента должна состоять полностью из R субъединиц или T субъединиц, и не может содержать смесь этих форм. В растворе эти две формы находятся в равновесии. Поскольку смесей типов субъединиц в индивидуальном белке невозможны, в растворе возникает простое равновесие между белками, состоящими полностью из R и T субъединиц.
Для объяснения работы модели нужно сделать еще два предположения:
- Во-первых в растворе и в отсутствии любых лигандов (субстрата или аллостерического эффектора) равновесие сдвинуто в сторону T-формы.
- Во-вторых, конформация активных центров такова, что R-состояние имеет более высокое сродство к лиганду. Это не обязательно означает, что T форма неспособна к связыванию лиганда, просто у нее более низкое сродство.
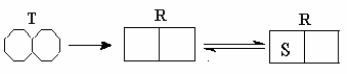 |
Если добавляется небольшое количество лиганда к этому раствору, более вероятно, что он свяжется с R белком, поскольку тот имеет более высокое сродство. Это приведет к образованию комплекса, в котором белок R со связанной молекулой лиганда, утратит способность переходить в Т форму, что сместит сложившееся равновесие вправо, увеличив число R белков с высоким сродством к лиганду и увеличив тем самым общее сродство к лиганду в системе. Результат - положительная кооперативность - связывание одной молекулы лиганда а увеличивает способность белка, связывать другие молекулы лигандов.
 Аллостерические эффекторы. Влияние эффекторов на ферменты можно объяснить просто, добавив к сказанному выше, что у фермента есть два центра связывания лигандов. Роль одного лиганда будет выполнять субстрат, взаимодействующий с активным центром, а второй лиганд – эффектор, связывающийся со специальным аллостерическим центром. Субъединицы фермента также могут принимать или R или T конформации. Активатор хорошо связывается с ферментом, который находится в R-конформации, обладающей одновременно высоким сродством к субстрату. Связывание активатора смещает равновесие в сторону R конформации с высоким сродством к субстрату, что способствует повышению скорости реакции.(«носок» на сигмовидной кривой). Чем выше концентрация активатора, тем выше скорость реакции и тем более похожей на гиперболу становится график зависимости скорости реакции от концентрации субстрата (сглаживание «носка» на кривой), и при больших количествах активатора на графике возникает гипербола. Эффектор со свойствами ингибитора имеет более высокое сродство к T-конформации. Его присоединение смещает равновесие в противоположном направлении, к появлению в растворе ферментов с низким сродством к субстрату и уплощению и удлинению «носка» на графике.
Аллостерические эффекторы. Влияние эффекторов на ферменты можно объяснить просто, добавив к сказанному выше, что у фермента есть два центра связывания лигандов. Роль одного лиганда будет выполнять субстрат, взаимодействующий с активным центром, а второй лиганд – эффектор, связывающийся со специальным аллостерическим центром. Субъединицы фермента также могут принимать или R или T конформации. Активатор хорошо связывается с ферментом, который находится в R-конформации, обладающей одновременно высоким сродством к субстрату. Связывание активатора смещает равновесие в сторону R конформации с высоким сродством к субстрату, что способствует повышению скорости реакции.(«носок» на сигмовидной кривой). Чем выше концентрация активатора, тем выше скорость реакции и тем более похожей на гиперболу становится график зависимости скорости реакции от концентрации субстрата (сглаживание «носка» на кривой), и при больших количествах активатора на графике возникает гипербола. Эффектор со свойствами ингибитора имеет более высокое сродство к T-конформации. Его присоединение смещает равновесие в противоположном направлении, к появлению в растворе ферментов с низким сродством к субстрату и уплощению и удлинению «носка» на графике.
Симметричная модельобъясняет свойства аллостерических ферментов простым и изящным способом, однако свойства некоторых ферментов лучше объясняются последовательной моделью.
Последовательная модель. Симметричная модель была основана на условии, что одна молекула фермента содержит только один тип субъединиц - R или T. Последовательная гипотеза обращается к возможности существования смешанных ферментов, содержащих оба типа. Равновесие лишь достигается в растворе, в котором законченные R и T структуры просто представляют экстремальные значения:






