ОСНОВИ ТЕРМОДИНАМІКИ. ОДНОКОМПОНЕНТНІ СИСТЕМИ.
Система та її стани. Параметри та функції стану системи. Перший закон термодинаміки. Внутрішня енергія. Теплота та робота для різних процесів. Теплоємність. Ентальпія.
Інтенсивні та екстенсивні величини. Ентропія. Обчислення ентропії та її фізичний сенс. Абсолютні ентропії, постулат Планка.
Функції стану. Вільна енергія: енергія Гельмгольца та енергія Гіббса. Рівняння Гіббса - Гельмгольца. Співвідношення Максвелла. Методи обчислення та фізичний зміст вільної енергії.
Принцип Нернста. Критерії самочинного перебігу процесів. Другий закон термодинаміки. Напрямок процесів в ізольованій системі.
Термодинаміка фазових переходів. Рівняння Клапейрона -Клаузіуса. Діаграми стану однокомпонентних систем.
Реальні гази. Рівняння стану, рівняння Ван-дер-Ваальса. Леткість реальних газів та методи її обчислення.
Фізична хімія конденсованого стану однокомпонентних систем.
Література: [1-13].
Робота № 1/1. Визначення теплоємності речовин.
Мета роботи. Визначити питому і молярну теплоємність твердого тіла.
Методика роботи. У калориметрі (опис приладу і порядок роботи з ним наведено в роботі № 4/1) вимірюють кількість теплоти, яка необхідна для нагрівання речовини масою m на Δt °С. За цими даними і сталою калориметра обчислюють питому теплоємкість С - кількість теплоти, необхідної для нагрівання одиниці маси речовини на І К.
Порядок роботи. У калориметр приміщують 500 мл дистильованої води. Пропустивши через нагрівач струм, вимірюють зміну температури Δt та величину теплового ефекту (ΔH, Дж) за рівнянням:
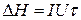 (1)
(1)
де I - сила струму, А; U- напруга, В; τ - час пропускання струму, с.
Відношення
 (2)
(2)
називають сталою калориметра. З фізичного погляду K1 - це сума теплоємностей усіх частин калориметра, тобто
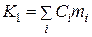 (3)
(3)
де Ci - питома теплоємність речовини; mi - його маса.
Визначення K1 за рівнянням (2) проводять чотири — п'ять разів та знаходять його середнє значення.
Після цього поміщають у калориметр певну наважку (150 -200 г) досліджуваної (не розчинної у воді) речовини (звичайно метал) та, повторюючи описану вище процедуру, знаходять значення K2.
Величина K2 відрізняється від K1 на теплоємність досліджуваної речовини, тобто
 (4)
(4)
де m0 - наважка, г, а C0 - питома теплоємність досліджуваної речовини, Дж/г.
З рівняння (4) знаходять C0, а далі обчислюють мольну теплоємність досліджуваної речовини:
 (5)
(5)
де М - молекулярна маса речовини.
Література: [20, с. 24 - 25; 24, с. 144].
Робота № 1/2. Визначення тиску насиченої пари індивідуальної рідини динамічним методом
Мета роботи. Визначити залежність тиску насиченої пари певної рідини від температури та знайти величини мольної теплоти випаровування.
Методика роботи. Якщо припустити, що поведінка пари описується рівнянням стану ідеального газу, а теплота випаровування не залежить від температури кипіння, то залежність тиску насиченої пари від температури описується рівнянням Клапейрона – Клаузіуса
 (1)
(1)
що після інтегрування дає
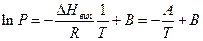 (2)
(2)
Таким чином, для визначення теплоти випаровування необхідно мати залежність тиску насиченої пари від температури.
Порядок роботи.
1. На робочому столі зібрати та підготувати до роботи експериментальний пристрій (рис 1). Під наглядом викладача (інженера) перевірити стан усіх її основних вузлів (шліфи, крани, системи електро- та водоживлення та ін.).
2. У реактор 1 додати декілька гранул неглазурованої порцеляни, щоб запобігти місцевим перегрівам, та залити близько 50 мл рідини, що досліджується. У підготовленому стані реактор з термометром 2 перенести в термостат 3 та за допомогою шліфів та кранів 4 та 5 з'єднати з холодильником 6, вакуумною системою, манометром та атмосферою. Пересвідчившись у надійності герметичності зібраного пристрою, увімкнути термостат. За заданого значення зовнішнього тиску і температури води в термостаті рідина в реакторі нагрівається. Початок кипіння рідини супроводжується інтенсивним виділенням бульбашок пари. У цей час необхідно слідкувати за температурою. У таблицю попередніх даних слід записати лише такі значення температури (до десятих часток градуса) і рівнів ртуті у колінах манометра h1 та h2, що далі вже не змінюються, а при цьому частота крапель конденсату з холодильника становить 2-3 с. Друге і наступні вимірювання Pпари і температури здійснюються після підвищення зовнішнього тиску в реакторі на 20-25 мм рт. ст. (за сумою h1 + h2). Операцію з підвищення тиску треба виконувати обережно, щоб уникнути різкого перенесення ртуті в праве коліно манометричної трубки, а то й навіть її викидання до пастки 7. Слід мати на увазі, що верхнє значення Tкип даної речовини в умовах досліду залежить не лише від тиску в реакторі, але й від природи рідини та можливостей самого термостата.
3. Для зміни тиску насиченої пари в умовах досліду вакуумування реактора проводити доти, доки рівень ртуті в манометрі не підніметься до верхньої позначки на його шкалі ліворуч (h1). Після кожного встановлення теплової рівноваги між двома фазами "рідина — пара" записати рівні ртуті на манометрі та показання термометра. Усього мас бути 9-12 точок. Дослід закінчують тоді, коли температура води в термостаті досягне 80-85 °С.
4. За рівнянням  знайти значення тиску насиченої пари, що відповідає певному значенню температури, та побудувати графіки: Pпари – t, °C та lnPпари – 1/T.
знайти значення тиску насиченої пари, що відповідає певному значенню температури, та побудувати графіки: Pпари – t, °C та lnPпари – 1/T.
5. За допомогою графіка знайти значення мольної теплоти випаровування рідини, що досліджується, та порівняти з величиною, що задається наближеним рівнянням за правилом Труттона:

де індекс “н.т.к” означає температуру кипіння за нормальних умов.
6. За допомогою методу найменших квадратів (МНК) знайти числові значення коефіцієнтів А і В та скласти рівняння прямої лінії типу
 (3)
(3)
7. З величини коефіцієнта А, визначеного за МНК, обчислити більш точне значення мольної теплоти випаровування і порівняти з величиною, знайденою із експериментального графіка за схемою п. 5.

Рис. 1. Схема експериментального пристрою для вимірювання тиску насиченої пари: 1 - реактор; 2 - термометр; 3 - термостат; 4, 5 -крани; 6 - холодильник; 7 – пастка.
8. Отримавши рівняння прямої за МНК, знайти виправлені значення lnP’пари, що відповідають заданим значенням T, нанести на графік та провести пряму.
9. За рівнянням (3) знайти температуру кипіння досліджуваної рідини за нормального атмосферного тиску, отриману величину порівняти з довідковою.
10. Оцінити похибку вимірювань.
Інтегрування диференціального рівняння Клаузіуса -Клапейрона у вузькому температурному інтервалі приводить до рівняння
 (4)
(4)
звідки
 (5)
(5)
Після диференціювання і логарифмування цього рівняння отримаємо:
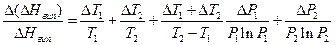 (6)
(6)
Наприклад, для CCl4 за T1 = 313 К і T2 = 323 К; P1 = 216 мм рт. ст. і P2 = 317 мм рт. ст.


Видно, що за точності вимірювання температури ±0,5 °С та точності вимірювання тиску ±0,5 мм. рт. ст. основний внесок у похибку визначення мольної теплоти випаровування досліджуваної рідини робить інтервал температур. За T2 – T1 = 10 °C відношення  становить ±10%.
становить ±10%.
Отже, в лабораторних умовах довести величину похибки до 2-3 % можна, якщо температурний інтервал становитиме 40-50 °С.
11. Вихідні дані, результати проміжних та кінцевих розрахунків занести в таблицю за схемою
| № | Pбар | Температура | h1 | h2 | h1+h2 | Pпари = Pбар – (h1+h2) | lnPпар | (103/T)2 | lnPпари ∙ (103/T) | lnP’ (за мнк) | ||
| t, °C | T, K | 103/T | ||||||||||
Література: [21, с. 61-66, 68, 69].






