Задачи для самостоятельного решения
1. Определить молярную массу углевода, если при растворении 1,8 г этого вещества в 100 г воды получен раствор с температурой кипения 100,0520 С.
2. Определить степень электролитической диссоциации хлорида кальция в 2,5% водном растворе, который замерзает при температуре -1,20 С.
3. Определить молярную массу неэлектроэлита, раствор которого с ω растворённого вещества 7,24% имеет ∆tзам. 2,42 и плотность 1,02 г/см3. Рассчитайте осмотическое давление (кПа) раствора данного неэлектроэлита при 370 С.
2. Лабораторная работа № 1: Определение молярной массы неэлектролита криоскопическим методом.
Ход работы:
1. Подготовить прибор для определения температуры замерзания (криоскоп). Для этого в наружный сосуд поместить кусочки льда, добавить охладительную смесь и перемешать.
2. Во внутренний сосуд с помощью бюретки отмерить 20 мл дистиллированной воды, поместить его в наружный сосуд с охлаждающей смесью и, непрерывно помешивая воду мешалкой, следить за изменением температуры. Когда начнется кристаллизация, отметить и записать температуру замерзания воды:
t з. (р-ль) =
3. Взвесить 2,0 г неэлектролита, растворить его в 20 мл дистиллированной воды и перелить приготовленный раствор в осушенный марлей внутренний сосуд криоскопа. Поместить этот сосуд в охлаждающую смесь и помешивать раствор мешалкой до наступления кристаллизации, отметить и записать температуру замерзания раствора:
t з. (р-р) =
4. Рассчитать молярную массу неэлектролита по формуле:
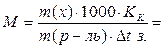 г/моль
г/моль
где: m(x) – масса растворенного вещества,
m(р-ль) – масса воды,
КK – 1,86 град/моль – криометрическая константа воды
Dtз. = t з.(р-ль) – t з. (р-р) =
| m н.э. | V(Н2О) | m(Н2О) | KК для (Н2О) | tЗ(р-ль) | tЗ(р-р) | ∆tЗ(р-р) | M н.э. |
Вывод: ________________
Лабораторная работа № 2: Определение осмотической концентрации и изотонического коэффициента электролита.[1]
Ход работы:
1. Взвесить 1,0 г хлорида натрия, растворить его в 20 мл дистиллированной воды (в химическом стаканчике) и перелить приготовленный раствор в чистый внутренний сосуд криоскопа.
2. Поместить этот сосуд в охлаждающую смесь и определить температуру замерзания раствора, как описано в работе № 1.
t з.(р-р) =
3. Рассчитать:
А) Δt з. эксп. = t з. (р-ль) – t з. (р-р) =
t з. (р-ль) взять из предыдущего опыта
Б) Δ t з. теор. = КК · b =
где b – моляльная концентрация раствора
В) i = Δt з. эксп. =
Δ t з. теор.
Г) С осм. = b · i = (моль/кг)
Осмотическая концентрация электролита может быть рассчитана по формуле:
С осм. = Δt з. эксп. =
КK
т. к. Δt з. эксп. = К· b · i
| tЗ(р-ль) | tЗ(р-р) | ∆tЗэксп. | ∆tЗтеор. | i | Сосм. |
В выводе указать экспериментально полученное значение изотонического коэффициента для электролита NaCl и сравнить с его максимально возможным теоретическим значением. Объяснить, почему определяемый изотонический коэффициент отличается от теоретического.
Вывод: _____________________
____
Дата ________ Подпись преподавателя_______________
Методические указания
К занятию № 9
Тема: Равновесные биохимические процессы. Буферные растворы.
Цель: Сформировать знания принципов строения буферных систем, а также механизмов буферного действия, обеспечивающих поддержание постоянства рН. Освоить титриметрический метод определения буферной емкости крови.
Исходный уровень:
1. Определение понятий: титрант, титруемый раствор.
2. Химический эквивалент вещества в кислотно-основных реакциях, количество эквивалентов вещества, фактор эквивалентности. Закон эквивалентов.
3. Ионное произведение воды. Водородный показатель.
Вопросы для обсуждения:
1. Буферные системы, их классификация.
2. Механизм действия буферных систем.
3. Вычисление рН и pOH буферных растворов. Уравнение Гендерсона-Гассельбаха.
4. Буферная емкость и факторы, ее определяющие.
5. Буферные системы человеческого организма. Нарушение кислотно-основного равновесия крови. Ацидоз, алкалоз.
Рекомендуемая литература для подготовки:
1. Болтромеюк В.В. Общая химия. Минск: Выш. шк., 2012. ст. 129-148.
2. Болтромеюк В.В. Физическая и коллоидная химия. Общая химия. Гродно: ГГМУ, 2010. ст. 141-160.
3. Болтромеюк В.В. Общая химия. Гродно: ГГМУ, 2009. ст. 141-160
4. Равич-Щербо М.И., Новиков В.В. Физическая и коллоидная химия. М., 1975, с. 77-79, 90 – 100.
5. Ленский А.С. Введение в бионеорганическую и биофизическую химию. М., cт. 151-160.
6. Конспект лекций.






