Лабораторная работа: Определение молярной концентрации эквивалентов и титра KMnO4 по рабочему раствору щавелевой кислоты.
Ход работы:
В основе метода лежит следующая окислительно-восстановительная реакция:
2 KMnO4 + 5 H2C2O4 + 3 H2SO4 = 2 MnSO4 + K2SO4 + 10 CO2 + 8 H2O
Для титрования заполняют бюретку раствором перманганата калия (KMnO4). В колбу для титрования пипеткой отмеряют 5 мл рабочего раствора щавелевой кислоты и 5 мл 2 н. раствора H2SO4. Колбу нагревают, не доводя до кипения, и горячий раствор титруют раствором перманганата калия из бюретки. Титрование повторяют 3 раза.
Вычисляют средний объем KMnO4, пошедший на титрование. Находят молярную концентрацию эквивалентов и титр раствора KMnO4.
Расчет: вычисляют средний объем (V) KMnO4,, пошедший на титрование с точностью до сотых
V ср. (KMnO4) = V1+V2+V3 = мл
Находят молярную концентрацию эквивалентов c[1/z*(KMnO4)] по формуле:
 =
=
(с точностью до четвертого знака после запятой)
Т(Х) = 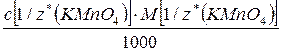 =
=
(с точностью до четвертой значащей цифры после запятой)
Расчеты заносят в таблицу
| V1 (KMnO4) | V2 (KMnO4) | V3 (KMnO4) | Vср. (KMnO4) | c[1/z*(KMnO4)] | Т (KMnO4) |
В выводе объясните, почему перманганатометрическое титрование проводится при нагревании и в соответствующей кислотно-основной среде. Как фиксируется точка эквивалентности в данном методе?
Вывод: ______________________________________
Дата ________ Подпись преподавателя_______________
Методические указания
К занятию № 8
Тема: Коллигативные свойства растворов.
Цель: Изучить коллигативные свойства разбавленных растворов неэлектролитов и электролитов, имеющие важное значение для функционирования биологических систем. Освоить криоскопический метод определения молярной массы неэлектролита и изотонического коэффициента электролита.
Исходный уровень:
1. Определение понятий: растворы, электролитическая диссоциация, электролиты, неэлектролиты.
2. Степень диссоциации электролитов.
Вопросы для обсуждения:
1. Коллигативные свойства растворов. Осмос и осмотическое давлениевразбавленных растворах неэлектролитов. Закон Вант-Гоффа.
2. Роль осмотического давления в биологических системах. Гипо-, гипер- и изотонические растворы. Лизис и плазмолиз.
3. Давление насыщенного пара над растворами. Закон Рауля для разбавленных растворов неэлектролитов и следствия из него.
4. Коллигативные свойства разбавленных растворов электролитов. Изотонический коэффициент.
5. Криометрия, эбулиометрия и осмометрия как методы медико-биологических исследований.
Рекомендуемая литература для подготовки:
1. Болтромеюк В.В. Общая химия. Минск: Выш. шк., 2012. ст. 80-102.
2. Болтромеюк В.В. Общая химия. Гродно: ГГМУ, 2009. ст. 87-109
3. Болтромеюк В.В. Физическая и коллоидная химия. Общая химия. Гродно: ГГМУ, 2010. ст. 87-109
4. Ленский А.С. Введение в бионеорганическую и биофизическую химию, М.,1989. с. 112-125.
5. Равич-Щербо М.И., Новиков В.В. Физическая и коллоидная химия. М., Высш. школа, 1975. С.33-45.






