При работе с растворимыми мелкодисперсными антигенами применяют реакцию непрямой, или пассивной, гемагглютинации (РИГА, РПГА). Антиген сначала адсорбируют на инертных монодисперсных частицах или клетках, например на эритроцитах готовят эритроци-тарный диагностикум. Такие нагруженные антигеном эритроциты склеиваются под действием иммунной сыворотки, содержащей антитела к данному антигену (рис. 10.2.2).
| Рис. 10.2.1. Реакция агглютинации. а — хорошо выражена; б — плохо выражена. |
Реакция отличается высокой чувствительностью и позволяет выявлять сравнительно небольшие концентрации антител в исследуемой сыворотке. Реакцию ставят на пластмассовой пластине, в лунках которой готовят последовательные
разведения сыворотки больного. В каждую лунку вносят одинаковый объем (0,5 мл) 3 % суспензии нагруженных антигенами эритроцитов — соответствующего эрИтроцитарного диа-гностикума. Через 2 ч инкубации при 37 °С учитывают результат по характеру осадка эритроцитов.

|
| Рис. 10.2.2. Реакция непрямой гемагглютинации. Эр — эритроциты; АГ — антиген; AT — антитело. |
7. Реакция преципитации в геле. Иммунодиффузия в агаро
вом геле растворов антигенов и антител, залитых в разные
лунки, навстречу друг другу в случаях соответствия их специ
фичности приводит к образованию специфического преципи
тата в виде полосок и дуг в местах встречи реагентов.

 Как правило, в центральную лунку заливают стандартный раствор антигена, а в периферические — испытуемые сыворотки. В одну из периферических лунок вносят стандартную иммунную сыворотку соответствующей специфичности, а в другую — нормальную сыворотку для контроля. Антиген с сыворотками инкубируют во влажной камере при 37 °С в течение 24 ч, после чего учитывают количество и ширину полос преципитации между центральной лункой с раствором антигена и лунками с исследуемыми сыворотками.
Как правило, в центральную лунку заливают стандартный раствор антигена, а в периферические — испытуемые сыворотки. В одну из периферических лунок вносят стандартную иммунную сыворотку соответствующей специфичности, а в другую — нормальную сыворотку для контроля. Антиген с сыворотками инкубируют во влажной камере при 37 °С в течение 24 ч, после чего учитывают количество и ширину полос преципитации между центральной лункой с раствором антигена и лунками с исследуемыми сыворотками.
8. Реакция лизиса. Реакция связывания комплемента. Для постановки реакции лизиса и РСК используют комплемент, который содержится в сыворотке крови морских свинок. Гемолитическая активность комплемента термолабильна и полностью утрачивается при прогревании сыворотки в течение 30 мин при 56 "С. При адсорбции комплемента на комплексе антиген—антитело его действие проявляется реакцией лизиса антигена, если антиген корпускулярный, или не сопровождается видимыми изменениями, если это мелкодисперсные или растворимые антигены. Для учета результатов РСК вводят вспомогательную {индикаторную) гемолитическую систему. Она состоит из взвеси эритроцитов барана в изотоническом растворе хлорида натрия и гемолитической сыворотки кролика, полученной путем его иммунизации упомянутыми эритроцитами. Положительная РСК характеризуется задержкой гемолиза вследствие адсорбции комплемента системой антиген—антитело (рис. 10.2.3). Отрицательная РСК характеризуется наличием гемолиза, поскольку свободный комплемент связывается с индикаторной системой антиген—антитело, т.е. эритроциты барана — гемолитическая сыворотка кролика. РСК обладает высокой чувствительностью и специфичностью, что позволяет использовать ее для серодиагностики многих заболеваний.
Для постановки РСК требуется точное определение количественных соотношений всех ингредиентов, участвующих в реакции: исследуемой сыворотки, антигена, комплемента, гемолитической сыворотки кролика и эритроцитов барана. Поэтому постановке основного опыта предшествует титрование гемолитической сыворотки и выбор ее рабочего разведения, титрование других ингредиентов.
Постановка РСК должна сопровождаться контролями для проверки отсутствия антикомплементарных ингредиентов в препаратах антигенов и в исследуемой сыворотке. Антикомплементарные свойства антигенов или сыворотки могут быть связаны с присутствием в их составе денатурированных или агрегированных иммуноглобулинов, гепарина, оксидантов, микробных контаминант. Эти компоненты могут либо связывать комплемент, либо связывать и удалять ионы кальция или магния, необходимые для комплементопосредованного гемолиза.

Рис. 10.2.3. Реакция связывания комплемента. АГ — антиген; AT — антитело; Эр — эритроциты; Гем.сыв. — гемолитическая
сыворотка.
Титрование комплемента. Для определения титра и рабочей дозы производят титрование комплемента с помощью реакции иммунного гемолиза (табл. 10.2.1).
Таблица 10.2.1. Титрование комплемента (форма протокола)

|
Манипуляции Номера пробирок
12 3 4 5 6 7 8 9
Внесение ком- 0,3 0,2 0,1 0,1 0,1 0,1 0,1 - -племента в разведении 1:5 мл
Внесение изото- 0,3 0,4 0,3 0,4 0,5 0,6 0,7 0,2 — нического раствора хлорида натрия, мл
Удаление из 0,4 0,4 0,2 0,3 0,4 0,5 0,6 - -
пробирки избытка, мл
Получаемые 1:10 1:15 1:20 1:25 1:30 1:35 1:40 - -
разведения комплемента
Добавление ге- 0,4 0,4 0,4 0,4 0,4 0,4 0,4 0,4 0,4
молитической
смеси, мл
Инкубация 390 мин при температуре 37 "С Учет результатов

 Свежую сыворотку морской свинки разводят изотоническим раствором хлорида натрия от 1:10 до 1:40. К 0,2 мл каждого разведения комплемента добавляют по 0,4 мл гемолитической смеси (смеси равных объемов 3 % суспензии эритроцитов в изотоническом растворе хлорида натрия и гемолитической сыворотки в разведении, соответствующем ее тройному титру). Пробирки выдерживают при 37 "С и через 30 мин определяют титр комплемента — наибольшее разведение комплемента, которое вызывает полный лизис эритроцитов в присутствии гемолитической сыворотки. Рабочую дозу комплемента рассчитывают, исходя из его титра. Рабочая доза комплемента должна быть выше титра на 25 %. Например, при титре комплемента 1:20 в качестве рабочей дозы берут его предыдущее разведение 1:10 (см. табл. 10.2.1).
Свежую сыворотку морской свинки разводят изотоническим раствором хлорида натрия от 1:10 до 1:40. К 0,2 мл каждого разведения комплемента добавляют по 0,4 мл гемолитической смеси (смеси равных объемов 3 % суспензии эритроцитов в изотоническом растворе хлорида натрия и гемолитической сыворотки в разведении, соответствующем ее тройному титру). Пробирки выдерживают при 37 "С и через 30 мин определяют титр комплемента — наибольшее разведение комплемента, которое вызывает полный лизис эритроцитов в присутствии гемолитической сыворотки. Рабочую дозу комплемента рассчитывают, исходя из его титра. Рабочая доза комплемента должна быть выше титра на 25 %. Например, при титре комплемента 1:20 в качестве рабочей дозы берут его предыдущее разведение 1:10 (см. табл. 10.2.1).
Антигены изготавливают из взвесей убитых микроорганизмов, их лизатов, полных антигенов, гаптенов, тканевых экстрактов.
Взвесь эритроцитов барана получают из дефибринирован-ной крови барана, отмывая эритроциты изотоническим раствором хлорида натрия до получения полной бесцветности и прозрачности надосадочной жидкости и готовят из них 3 % взвесь в изотоническом растворе хлорида натрия.
Гемолитическая сыворотка готовится путем 3—4-кратной внутривенной иммунизации кролика 50 % взвесью бараньих эритроцитов и инактивируется при 56 "С (разрушен комплемент). На этикетке ампул с сывороткой обозначен ее титр — максимальное разведение данной сыворотки, которое обеспечивает полный лизис 3 % взвеси эритроцитов барана в присутствии комплемента при 37 "С в течение часа. Для РСК берут гемолитическую сыворотку в тройном титре (рис. 10.2.4; на вклейке).
Постановка основного опыта Р С К. После установления титра и рабочих доз всех ингредиентов ставят основной опыт РСК (табл. 10.2.2).
Таблица 10.2.2. Основной опыт реакции связывания комплемента
(форма протокола)_____________________________________
Манипуляции Номера пробирок
1 2 3 4 5 6 7
Внесение испытуемой сыво- 0,2 — — 0,2 — — —
ротки в разведении 1:5, мл
Внесение заведомо "поло- — 0,2 — — — — —
жительной" сыворотки, мл
Внесение заведомо "отри- — — 0,2 — — — —
цательной" сыворотки, мл
Внесение антигена, мл 0,2 0,2 0,2 — 0,2 — —
Продолжение
| Манипуляции | Номера пробирок | ||||||
Внесение изотонического — — — 0,2 0,2 0,4 0,4 раствора хлорида натрия, мл
Внесение комплемента в ра- 0,2 0,2 0,2 0,2 0,2 0,2 0,2 бочей дозе, мл
Инкубация при 0—4 "С в течение 18—20 ч или при 37 "С в течение 30 мин Добавление гемолитической 0,4 0,4 0,4 0,4 0,4 0,4 0,4 смеси, мл
Инкубация при 37 "С в течение 20—30 мин Учет результатов
Испытуемую и контрольные сыворотки предварительно ин-активируют нагреванием при 56 °С в течение 30 мин. Стандартная схема постановки РСК предусматривает проведение первой фазы инкубации смеси антигена, испытуемой сыворотки и комплемента при 37 "С в течение 30 мин. При постановке РСК на холоде эту фазу проводят при 0—4 "С в течение 18—20 ч, что повышает чувствительность реакции.
После добавления в каждую пробирку по 0,4 мл гемолитической смеси пробирки встряхивают и выдерживают 20—30 мин при 37 °С. Результаты опыта оценивают, отмечая наличие или отсутствие гемолиза во всех пробирках (см. табл. 10.2.2). Реакцию считают положительной при полной задержке гемолиза, когда жидкость в пробирке бесцветна и эритроциты оседают на дно, отрицательной — при полном лизисе эритроцитов, когда жидкость интенсивно окрашена ("лаковая кровь"). Степень задержки гемолиза оценивают в зависимости от интенсивности окраски жидкости и величины осадка эритроцитов на дне (++++, +++, ++, +) _ см. рис. 10.2.4.
В качестве контроля (2-я и 3-я пробирки) учитывают реакцию с заведомо положительной и заведомо отрицательной сыворотками, 4-я и 5-я пробирки служат для проверки антикомплементарных свойств сыворотки и антигена, в 6-й и 7-й пробирках контролируются рабочая доза комплемента и качество гемолитической смеси (см. табл. 10.2.2).
9. Реакция Кумбса. Сложность выявления неполных (моновалентных) антител связана с тем, что эти антитела, связываясь с эпитопами специфического антигена, не образуют структуру решетки и реакция между антигенами и антителами не выявляется ни агглютинацией, ни преципитацией, ни другими тестами. Для выявления образовавшихся комплексов антиген—
 |

|
Рис. 10.2.5. Реакция Кумбса (схема). Объяснение в тексте.
его минимальным количеством, которое дает инициальную флоккуляцию с 1 международной единицей (ME) сыворотки. Установив силу токсина, приступают к титрованию антитоксической сыворотки. Известной силы токсин и испытуемую антитоксическую сыворотку разливают в пробирки в определенном объеме, как показано в табл. 10.2.3. Пробирки выдерживают в водяной бане при температуре 45 °С в течение 30 мин до выпадения хлопьев в одной из них.
Таблица 10.2.3. Реакция флоккуляции (форма протокола)
| Манипуляции | Номера пробирок | ||||||
Внесение раствора токсина, 2,0 2,0 2,0 2,0 2,0 2,0 2,0
содержащего 20 Lf в 1 мл,
мл
Внесение исследуемой сы- 0,2 0,3 0,4 0,5 0,6 — 0,6
воротки, мл
Инкубация при 45 °С в течение 30 мин Учет результатов по инициальной флоккуляции

 антитело приходится использовать дополнительные тест-системы. Для выявления неполных антител, например к резус-антигену эритроцитов в сыворотке крови беременной женщины, реакция ставится в два этапа: 1) к двукратным разведениям испытуемой сыворотки добавляют эритроциты, содержащие резус-антиген, и выдерживают при 37 °С в течение часа; 2) к тщательно отмытым после первого этапа эритроцитам добавляют кроличью античеловеческую антиглобулиновую сыворотку (в заранее оттитрованном рабочем разведении). После инкубации в течение 30 мин при температуре 37 °С результаты оценивают по наличию гемагглютинации (положительная реакция). Необходимо ставить контроль ингредиентов реакции: 1) антиглобу-линовая сыворотка + заведомо сенсибилизированные специфическими антителами эритроциты); 2) обработанные нормальной сывороткой эритроциты + антиглобулиновая сыворотка; 3) обработанные исследуемой сывороткой резус-отрицательные эритроциты + антиглобулиновая сыворотка (рис. 10.2.5).
антитело приходится использовать дополнительные тест-системы. Для выявления неполных антител, например к резус-антигену эритроцитов в сыворотке крови беременной женщины, реакция ставится в два этапа: 1) к двукратным разведениям испытуемой сыворотки добавляют эритроциты, содержащие резус-антиген, и выдерживают при 37 °С в течение часа; 2) к тщательно отмытым после первого этапа эритроцитам добавляют кроличью античеловеческую антиглобулиновую сыворотку (в заранее оттитрованном рабочем разведении). После инкубации в течение 30 мин при температуре 37 °С результаты оценивают по наличию гемагглютинации (положительная реакция). Необходимо ставить контроль ингредиентов реакции: 1) антиглобу-линовая сыворотка + заведомо сенсибилизированные специфическими антителами эритроциты); 2) обработанные нормальной сывороткой эритроциты + антиглобулиновая сыворотка; 3) обработанные исследуемой сывороткой резус-отрицательные эритроциты + антиглобулиновая сыворотка (рис. 10.2.5).
10. Реакция флоккуляции. В результате взаимодействия токсина или анатоксина с антитоксической сывороткой выпадают хлопья флоккулята. Наиболее интенсивная и ранняя (инициальная) флоккуляция происходит в пробирке, где антиген и антитело содержатся в эквивалентных соотношениях.
Реакцию ставят в два этапа. Сначала по стандартной сыворотке устанавливают пороговую величину флоккуляции Lf (Limes flocculationis) в 1 мл токсина. Lf токсина определяется
Инициальная флоккуляция проявляется в той пробирке, где количество токсина соответствует количеству международных единиц сыворотки. Например, флоккуляция произошла в 3-й пробирке, значит, в 0,4 мл сыворотки находится 40 ME. Следовательно, 1 мл сыворотки содержит 40:0,4=100 ME.
11. Антистрептолизиновая реакция. Реакция основана на феномене нейтрализации гемолитического действия микробного токсина (О-стрептолизина) антитоксическими антителами иммунной сыворотки.
Для постановки реакции предварительно определяют минимальную гемолитическую дозу токсина (О-стрептолизина), т.е. наименьшее его количество, которое вызывает гемолиз 0,2 мл 5 % взвеси эритроцитов кролика. Затем определяют рабочую дозу О-стрептолизина, т.е. наибольшее количество токсина, которое в смеси с У2 АЕ (антитоксической единицы) стандартной антитоксической сыворотки полностью нейтрализуется и не вызывает гемолиза эритроцитов. Для постановки основного опыта готовят разведения исследуемой сыворотки, к каждому из которых добавляют рабочую дозу токсина, инкубируют 45 мин при 37 °С, затем вносят равный объем взвеси эритроцитов и инкубируют 1 ч при 37 'Си 18 ч при комнатной температуре. Обязательным является контроль на возможность спонтанного гемолиза эритроцитов. В качестве положительной учитывается реакция, где отсутствует гемолиз. С учетом максимального
 разведения сыворотки, при котором наблюдается полная задержка гемолиза, рассчитывают содержание АЕ в 1 мл испытуемой сыворотки (см. табл. 12.1.3).
разведения сыворотки, при котором наблюдается полная задержка гемолиза, рассчитывают содержание АЕ в 1 мл испытуемой сыворотки (см. табл. 12.1.3).
12. Реакция торможения гемагглютинации. РТГА основана на том, что при взаимодействии вирусных антигенов (гемагглю-тининов) со специфическими антителами иммунной сыворотки происходит блокирование (нейтрализация) гемагглютини-рующей способности вируса, т.е. торможение гемагглютинации.
Развернутая РТГА проводится в лунках пластмассовых пластин. Предварительно определяют титр вирусного антигена в реакции гемагглютинации с целью выбора рабочей дозы. Рабочее разведение берут в 16 раз меньше титра. В лунках готовят 2-кратные разведения исследуемой сыворотки в объеме 0,25 мл, добавляют по 0,25 мл взвеси вируса в рабочем разведении и инкубируют 2 ч при температуре 37 °С. Затем добавляют по 0,5 мл 1 % взвеси куриных эритроцитов, инкубируют еще 2 ч и оценивают результат по феномену гемагглютинации. При положительной РТГА образуется плотный осадок эритроцитов на дне лунки в виде диска или кольца с ровными краями. Титр антител определяют по последней лунке с положительной РТГА.
Разные методы количественного определения антигенов и антител существенно различаются по чувствительности, т.е. по тому минимальному количеству антигенов или антител, которое может быть выявлено с помощью данного метода (табл. 10.2.4).
Таблица 10.2.4. Сравнительная чувствительность разных методов количественного определения антител и антигенов
| Тесты | Выявляемое количество, мкг/мл | |
| антител | антигенов |
| 20,0 1,0 20,0 0,5 0,05 0,5 0,01 0,01 0,01 0,001 0,01 0,0005 0,000005 0,0005 0,000005 0,000005 |
Преципитация
Иммуноэлектрофорез
Связывание комплемента
Радиальная иммунодиффузия
Агглютинация бактерий
Гемолиз
Непрямая (пассивная) гемагглю-
тинация
Ингибиция гемагглютинации
Нейтрализация токсина
Радиоиммунный анализ
Иммуноферментный анализ
Нейтрализация вирусов
Тема 10.3. МЕТОДЫ ОЦЕНКИ ИММУННОГО СТАТУСА ОРГАНИЗМА ЧЕЛОВЕКА
Иммунный статус человека складывается из комплекса неспецифических и специфических механизмов, обеспечивающих антибактериальную, противовирусную и противоопухолевую защиту организма. К механизмам неспецифической защиты против бактерий относятся фагоцитоз гранулоцитами и моноцитами/макрофагами и активация системы комплемента по альтернативному пути. Макрофаги не только захватывают и убивают бактерии, но при контакте с ними продуцируют и секретируют биологически активные молекулы — цитокины, запускающие неспецифический защитный процесс воспаления. Механизмы неспецифической противовирусной и противоопухолевой защиты: клетки — естественные киллеры и молекулы семейства интерферонов. Специфическую антибактериальную защиту против внеклеточно паразитирующих бактерий обеспечивают специфические антитела — иммуноглобулины путем усиления фагоцитоза (опсонизация) или активации системы комплемента по классическому пути иммунными комплексами. Специфическая защита от бактериальных токсинов является функцией специфических антитоксических антител — иммуноглобулинов, способных нейтрализовать экзотоксины бактерий. Специфическую защиту против внутриклеточ-но паразитирующих микроорганизмов берут на себя активированные Т-лимфоциты и макрофаги, продуцирующие цитокины: интерлейкины, гамма-интерферон, фактор некроза опухоли, обеспечивая при этом развитие в очаге инфекции реакции иммунного воспаления — гиперчувствительности замедленного типа (ГЗТ). Специфическую противовирусную защиту обеспечивают активированные цитотоксические лимфоциты (CTL), способные распознать инфицированную клетку и убить ее при непосредственном контакте. В специфической противовирусной защите велика роль специфических антител иммуноглобулинов, которые могут нейтрализовать внеклеточные вирусы или вызвать гибель инфицированных вирусом клеток посредством антителозависимой клеточной цитотоксичности (АЗКЦТ) естественных киллеров и других клеток.
Оценка иммунного статуса включает количественную и качественную оценку основных факторов неспецифической защиты (фагоцитирующих клеток, системы комплемента, естественных киллеров, системы интерферонов) и основных звеньев иммунной системы: Т-лимфоцитов и их главных конечна* пР0ДУктов - цитокинов; В-лимфоцитов и их главных конечных продуктов — иммуноглобулинов.
на ^т°™чествен"ая оценка клеточных популяций начинается ци"™ клинического анализа крови, который дает информа-ч «и о количестве циркулирующих в крови гранулоцитов мо-
 ноцитов и лимфоцитов. Дальнейшая дифференцировка лимфоцитов основывается на наличии у них так называемых поверхностных маркеров, т.е. особых молекул (их принято обозначать "CD" — сокращение от английского термина "clusters of differentiation') в составе клеточных мембран, которые в качестве антигенов выявляются при взаимодействии со специфическими моноклональными антителами.
ноцитов и лимфоцитов. Дальнейшая дифференцировка лимфоцитов основывается на наличии у них так называемых поверхностных маркеров, т.е. особых молекул (их принято обозначать "CD" — сокращение от английского термина "clusters of differentiation') в составе клеточных мембран, которые в качестве антигенов выявляются при взаимодействии со специфическими моноклональными антителами.
Качественная (функциональная) оценка клеточных популяций и субпопуляций проводится с помощью соответствующих функциональных тестов: у Т- и В-лимфоцитов оценивают про-лиферативный ответ на контакт со стандартными митогенами или микробными антигенами (реакция бласттрансформации лимфоцитов — РБТЛ) или ответ продукцией цитокинов на контакт с митогеном. У фагоцитирующих клеток оценивают функцию фагоцитоза: активность захвата стандартных частиц — объектов фагоцитоза, бактерицидность фагоцитов косвенно оценивается по высоте окислительного взрыва, индуцированного фагоцитозом (НСТ-тест). Концентрацию молекул иммуноглобулинов четырех основных изотипов — классов (IgG, IgM, IgA, IgE) в сыворотке крови и в других биологических жидкостях (слюна, спинномозговая жидкость и др.) определяют, пользуясь наборами специфических моноклональных антител, полученных против изотипспецифических антигенов этих иммуноглобулинов. С помощью наборов таких антител можно проводить реакцию комплексообразования (иммуноглобулины, присутствующие в сыворотке крови, выполняют в этой реакции функцию антигенов), результаты которой поддаются количественному учету с помощью нефелометра или спектрофотометра. Другой вариант учета — проведение твердофазного иммуно-ферментного анализа с участием тех же изотипспецифических моноклональных антител и антииммуноглобулиновой меченной пероксидазой сыворотки против иммуноглобулинов мыши (так как все моноклональные антитела получены из клеток мышей).
▲ План
▲ Программа
1. Изучение методов оценки факторов неспецифической защиты организма.
2. Изучение методов оценки Т-системы иммунитета.
3. Изучение методов оценки В-системы иммунитета.
Демонстрация
1. Характерная морфология гранулоцитов, моноцитов и лимфоцитов в мазке крови, окрашенном по методу Романовского—Гимзы.
2. Отдельные стадии фагоцитоза бактерий и дрожжепо-добных грибов рода Candida макрофагами и грануло-цитами.
Задание студентам
1. Произвести микроскопический учет фагоцитоза частиц латекса лейкоцитами крови. Рассчитать показатели активности фагоцитирующих клеток.
2. Протоколировать и оценить результаты определения гемолитической активности комплемента сыворотки крови.
3. По готовым результатам выявления поверхностных маркеров на мембранах мононуклеарных лейкоцитов крови рассчитать показатели относительного и абсолютного количества естественных киллеров, В-лимфоцитов, Т-лимфоцитов, их субпопуляций в крови и сопоставить с интервалами колебаний этих показателей у здоровых лиц.
4. По готовым результатам иммуноферментного определения содержания в сыворотке крови иммуноглобулинов разных изотипов {IgG, IgM, IgA, IgE) сделать заключение, сопоставив эти результаты с интервалами колебаний этих показателей у здоровых лиц.
5. Обосновать выбор специальных тестов для характеристики функций иммунокомпетентных клеток.
Методические указания
1. Методы оценки фагоцитирующих клеток крови. Образец крови или лейковзвеси инкубируют с бактериями или другими объектами фагоцитоза (частицы латекса, полистиреновые частицы) в течение 1—2 ч, после чего из этой смеси приготавливают мазок, окрашивают по методу Романовского—Гимзы и микроскопируют, подсчитывая 100 клеток для определения процента фагоцитирующих клеток и количества бактерий (частиц), захваченных этими клетками (рис. 10.3.1; на вклейке). В норме процент фагоцитирующих лейкоцитов колеблется от 40 до 80 %, а количество захваченных частиц на 1 клетку — от 1 до 5.
В качестве косвенного показателя бактерицидное™ фагоцитирующих клеток оценивают интенсивность окислительного взрыва в фагоцитах по способности восстанавливать желтый краситель нитросиний тетразолий (НСТ) с формированием в цитоплазме клеток осадка темно-синего формазана. Чем активнее окислительный взрыв в фагоцитах, тем большая доля клеток содержит осадок формазана. После подсчета клеток доля формазан-положительных выражается в процентах. При инкубации лейкоцитов здоровых лиц только с красителем без индуктора окислительного взрыва доля формазан-положительных клеток не превышает 1—2 %. При инкубации лейкоцитов здоровых лиц в присутствии индуктора окислительного взрыва (объекты фагоцитоза, бактериальный липополисахарид или полисахарид) все 100 % фагоцитов могут ответить окислитель-

|
ным взрывом и накоплением осадка формазана. Снижение доли формазан-положительных клеток свидетельствует о дефектности кислородзависимого механизма бактерицидное™ фагоцитов.
2. Методы определения количества лимфоцитов в крови. Изучение лимфоцитов начинается с их выделения из крови. Мо-нонуклеарные лейкоциты (лимфоциты, моноциты) отделяют от других клеток крови (гранулоцитов и эритроцитов) с помощью центрифугирования в градиенте плотности специальной смеси препаратов: фикол, верографин. Взятая из вены кровь смешивается с антикоагулянтом, вносится в пробирку с названной смесью и центрифугируется. Имеющие большую плотность эритроциты и гранулоциты образуют осадок на дне пробирки, а мононуклеарные клетки образуют кольцо на поверхности градиентной смеси, откуда могут быть перенесены в отдельную пробирку и отмыты от градиентной смеси.
Все зрелые лимфоциты имеют одинаковую морфологию: малых лимфоцитов с плотным ядром и узким ободком цитоплазмы. Дифференцировка популяций и субпопуляций лимфоцитов связана с выявлением поверхностных маркеров — особых для каждого типа клеток антигенов с помощью соответствующих специфических антител.
Естественные киллеры несут поверхностный маркер CD16. Все Т-лимфоциты (тотально) несут поверхностный маркер CD3. Т-лимфоциты делятся на субпопуляции: Т-хелперы несут маркер CD4, а цитотоксические Т-лимфоциты (CTL) несут маркер CD8. Все В-лимфоциты несут поверхностный маркер CD 19. В-лимфоциты несут на поверхностной мембране поверхностные иммуноглобулины, которые могут быть выявлены в качестве антигенов с помощью флюоресцирующих антиимму-ноглобулиновых антител (в том числе — против отдельных изо-типов иммуноглобулинов). Эти поверхностные иммуноглобулины также рассматриваются как поверхностные маркеры В-лимфоцитов.
Определение количества лимфоцитов разных популяций и субпопуляций по поверхностным маркерам проводится с помощью двух разных вариантов методов:
—люминесцентной или световой микроскопии мазков цельной крови или взвеси мононуклеаров, обработанных соответствующими моноклональными антителами, меченными флюорохромом или ферментом;
—автоматического подсчета клеток с использованием проточного цитофлюориметра (рис. 10.3.2).
При использовании первого методического варианта важно получить видимый осадок комплексов антител с красителем на поверхности клетки. Этот метод очень трудоемкий и длитель-
| Клетки выше порога флюоресценции |
Клетки ниже порога флюоресценции
Рис. 10.3.2. Подсчет лимфоцитов разных популяций и субпопуляций с помощью проточного цитофлюориметра.
ный. Подсчет количества основных субпопуляций лимфоцитов данным методом занимает неделю.
В отличие от этого с помощью автоматизированного подсчета с использованием современного прибора — проточного цитофлюориметра — это удается сделать за один день. Образец цельной крови инкубируют с моноклональными антителами, меченными флюоресцентным красителем, пропускают через тонкую трубочку, на выходе из которой формируется струя из капель. Многие из них содержат только по одной клетке. Каждая капля проходит перед лазерным лучом. Если капля содержит клетку, клетка вызывает отклонение лазерного луча, а лазерный луч возбуждает свечение флюорохрома в молекуле антитела, связанного с антигеном на поверхности клетки (с поверхностным маркером). Чувствительный фотоумножитель
улавливает оба сигнала: светорассеяние дает информацию о размерах и гранулярности клетки, а флюоресценция дает информацию о количестве связанных клеткой меченых антител, т.е. об экспрессии поверхностных маркеров. В случае использования двух разных моноклональных антител, конъюгирован-ных с разными флюорохромами (флюоресцеин, дающий зеленое свечение, и фикоэритрин, дающий красное свечение), отдельные клетки оцениваются по интенсивности двух типов флюоресценции.
В результате исследования большого количества клеток (10 тыс. за 30 с) после компьютерной обработки прибор дает количественные данные о проценте клеток в данной популяции, несущих соответствующие поверхностные маркеры: CD3, CD4, CD8, CD16, CD19 и др.. (табл. 10.3.1).
Таблица 10.3.1. Количественное содержание лимфоцитов в циркулирующей крови здоровых людей
| Популяции | Поверх- | % от всего | Абсолютное количество клеток х Кг |
| и субпопуляции | ностные | количества | |
| лимфоцитов | маркеры | лимфоцитов | в 1 л крови |
| Лимфоциты (всего) | 1,50-3,50 | ||
| В-лимфоциты | CD19 | 15 (10-25) | 0,30-0,90 |
| Т-лимфоциты (всего) | CD3 | 75 (60-90) | 1,00-2,50 |
| Т-лимфоциты/хелперы | CD4 | 50 (32-65) | 0,50-1,60 |
| Т-лимфоциты/киллеры | CD8 | 25 (16-39) | 0,30-0,90 |
| Естественные киллеры | CD16 | 10 (5-15) | 0,20-0,30 |
3. Методы оценки функций лимфоцитов. Функциональную полноценность Т-лимфоцитов косвенно оценивают с помощью кожных проб, отражающих интенсивность реакций ГЗТ в отношении наиболее распространенных микробных антигенов: трихофитина, кандидозного аллергена, стрептококковых антигенов, туберкулина, дифтерийного анатоксина. Антиген вводят внутрикожно и через 48 ч измеряют диаметр инфильтрата — уплотнения, отражающий интенсивность реакции ГЗТ.
Покоящиеся лимфоциты циркулируют в крови в G0 фазе клеточного цикла. Важнейшей функцией лимфоцитов является пролиферация в ответ на распознавание конкретного антигена. Однако для изучения и оценки этой функции удобнее использовать в качестве стандартных индукторов пролиферации неспецифические поликлональные митогены. Для Т-лимфоцитов такими поликлональными митогенами являются препараты растительного происхождения (полученные из бобовых растений), для В-лимфоцитов — компоненты бактерий: липополи-сахарид клеточной стенки грамотрицательных бактерий и А-протеин стафилококка. После активации поликлональным

Рис. 10.3.3. Тест для оценки пролиферативной активности лимфоцитов: реакция бласттрансформации лимфоцитов.
митогеном лимфоцит быстро входит в G1 фазу и проходит весь клеточный цикл. Для количественной оценки этого процесса в популяции клеток обычно исследуют включение 3Н-тимиди-на в ДНК клеток как показатель их пролиферации. Этот тест пролиферативной активности лимфоцитов часто фигурирует под названием: реакция бласттрансформации лимфоцитов (рис. 10.3.3).
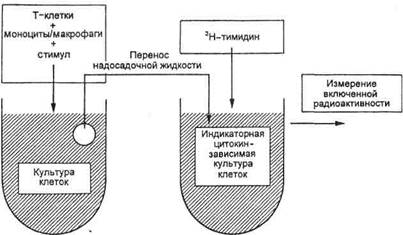
Другой подход к оценке функций Т-лимфоцитов заключается в измерении их способности продуцировать цитокины. При распознавании антигена и при ответе на поликлональные митогены Т-лимфоциты активируются и продуцируют неспецифические белки-медиаторы — цитокины. Определение типов цитокинов и их количества в культуральной среде Т-лимфоцитов позволяет оценить функциональную активность клеток (рис. 10.3.4). Количество цитокинов определяют, судя по их биологической активности, или выявляют цитокины как антигены с помощью специфических МКАТ и ИФА.
Функции В-лимфоцитов косвенно оценивают по уровням иммуноглобулинов и изогемагглютининов в сыворотке крови. С 2-летнего возраста в сыворотке крови людей с группой крови II(А) должны быть анти-В-антитела, в сыворотке крови людей с группой крови Ш(В) должны быть анти-А-антитела, а у людей с группой крови 1(0) должны присутствовать анти-А- и анти-В-изогемагглютинины.
4. Методы определения содержания в сыворотке крови иммуноглобулинов разных изотипов. Содержание в сыворотке крови иммуноглобулинов четырех основных изотипов (IgG, IgM, IgA, IgE) определяют, пользуясь наборами специфических антисы-

|
диффундирует радиально из лунок с его разведениями, взаимодействуя со специфическими антителами в геле. При этом образуются кольца преципитации, диаметр которых пропорционален концентрации антигена. Далее по калибровочному графику зависимости диаметра кольца от концентрации стандартного антигена определяют концентрацию иммуноглобулинов отдельных изотипов IgG, IgM, IgA в испытуемых образцах сывороток, предварительно измерив диаметры колец преципитации (табл. 10.3.2). Количественное содержание разных изотипов иммуноглобулинов в сыворотке крови проводят также с помощью твердофазного иммуноферментного анализа с участием изотип-специфических МКАТ и антииммуноглобулино-вой меченной пероксидазой сыворотки против иммуноглобулинов мыши (так как все МКАТ получены из клеток мышей).
Таблица 10.3.2. Количественное содержание иммуноглобулинов разных изотипов в сыворотке крови здоровых людей


 Рис. 10.3.4. Определение количества цитокина (фактора роста клеток) по его биологической (ростстимулирующей) активности.
Рис. 10.3.4. Определение количества цитокина (фактора роста клеток) по его биологической (ростстимулирующей) активности.
вороток или МКАТ, полученных против изотип-специфичес-ких антигенов этих иммуноглобулинов.
Для количественного определения содержания иммуноглобулинов разных изотипов в биологических жидкостях используют радиальную иммунодиффузию, твердофазный иммунофермент-ный анализ или РИА (при определении количества IgE).
Радиальная иммунодиффузия по Манчин и. На плоской поверхности создают равномерный слой геля, содержащий специфическую антиглобулиновую антисыворотку против одного из изотипов иммуноглобулинов. Из лунок, проштампованных в геле и заполненных испытуемыми сыворотками, молекулы иммуноглобулинов диффундируют в гель и образуют кольца преципитации с соответствующими антииммуноглобу-линовыми антителами. Диаметр колец преципитации увеличивается до тех пор, пока не истощится в данном образце сыворотки иммуноглобулин, который служит антигеном.
Радиальная иммунодиффузия пригодна для количественного определения любых классов сывороточных иммуноглобулинов. Образцы исследуемых сывороток помещают в лунки агаровых гелей, которые содержат антитела против IgG, IgM или IgA в известной концентрации. Одновременно в ряд лунок вносят стандартный антиген (иммуноглобулин определенного класса) в разных концентрациях. Диффундирующие в агар иммуноглобулины образуют с антиглобулиновыми антителами кольца преципитации, диаметр которых отражает содержание в сыворотке иммуноглобулинов соответствующего класса. Стандартный антиген (иммуноглобулин определенного класса)
| Изотип иммуноглобулина | Обозначение | % от всех иммуноглобулинов сыворотки | Количество иммуноглобулинов, г/л |
| средние величины | интервалы колебаний |
Иммуноглобулин G IgG 70-75 12,0 7,50-15,50
Иммуноглобулин М IgM 8—10 1,2 0,65—1,65
Иммуноглобулин A IgA 15—20 2,0 1,25—2,50
Иммуноглобулин Е IgE 0,005 0,0005 0-0,0005
Титрование комплемента сыворотки крови. Метод основан на феномене комплементзависимого лизиса нагруженных антителами эритроцитов барана. В соответствии с международным стандартом за единицу активности комплемента принимается такое его количество, которое вызывает гемолиз 50 % сенсибилизированных эритроцитов в стандартных условиях и обозначается СН50.
В пробирку с сывороткой крови в разведении 1:10 добавляют гемолитическую систему (смесь эритроцитов барана с гемолитической сывороткой кролика). После 45-минутной инкубации при 37 °С сохранившиеся эритроциты осаждают центрифугированием. Интенсивность гемолиза регистрируется фотометрически. Затем рассчитывают количество СН50 на 1 мл цельной сыворотки. У здоровых людей титр комплемента может колебаться в интервале 40—80 СН50 на 1 мл.
Титрование комплемента по 50 % гемолизу не позволяет судить о состоянии отдельных компонентов системы комплемента. В настоящее время отдельные компоненты системы комплемента определяют иммунохимически при помощи стандартных моноспецифических антисывороток.
Тема 10.4. МЕТОДЫ ОЦЕНКИ КЛЕТОЧНОГО И ГУМОРАЛЬНОГО ИММУННОГО ОТВЕТА. ВАКЦИНЫ. ИММУННЫЕ СЫВОРОТКИ И ИММУНОГЛОБУЛИНЫ
Иммунный ответ на инфекцию или иммунизацию вакцинными препаратами позволяет оценить функциональную активность иммунной системы в целом. Выявление в организме продуктов иммунного ответа свидетельствует о том, что человек был инфицирован соответствующим возбудителем, что имеет большое эпидемиологическое значение. Нередко выявление той или иной формы специфического иммунного ответа на конкретный антиген позволяет уточнить диагностику заболевания.
Оценка гуморального иммунного ответа базируется на выявлении специфических антител в сыворотке крови и других биологических жидкостях. Как правило, речь идет об определении количества антител (титра). Наиболее информативным считается определение количества антител в динамике инфекционного заболевания, так как именно нарастание титра антител свидетельствует о текущей инфекции. Нарастание титра антител можно использовать и для оценки эффективности проведенной вакцинации. Диагностическую значимость имеет определение принадлежности специфических антител к тому или иному изотипу иммуноглобулинов: для первичной инфекции наиболее характерно накопление антител изотипа IgM, a рецидив инфекции сопровождается преобладанием антител изотипа IgG.
Клеточно-опосредованный иммунный ответ оценивается чаще всего с помощью кожных проб. При внутрикожном введении небольшой дозы экстракта из микроорганизма, содержащего его антигены, в положительном случае наблюдается покраснение, припухание и уплотнение (инфильтрат) на месте введения через 24—48 ч. Положительная реакция свидетельствует об инфицировании человека соответствующим микроорганизмом, которое привело к формированию в организме клона Т-лимфоцитов, способных распознать его антигены и активироваться. Положительная кожная проба может быть результатом эффективной вакцинации против соответствующей инфекции.
План
А Программа
1. Возможности методов серодиагностики при оценке гуморального иммунного ответа.
2. Методы выявления иммунных комплексов.
3. Кожно-аллергические пробы для оценки клеточного
иммунитета и реакции гиперчувствительности замедленного типа.
4. Методы выявления специфической сенсибилизации Т-лимфоцитов.
5. Получение и применение вакцин, анатоксинов.
6. Получение и применение иммунных сывороток и иммуноглобулинов.
Демонстрация
1. Результаты теста торможения миграции лейкоцитов крови в присутствии причинного антигена.
2. Набор ампулированных препаратов инфекционных аллергенов, вакцин, сывороток, иммуноглобулинов, диагностикумов.
Задание студентам
1. Протоколировать и оценить результаты развернутых реакций агглютинации, поставленных с парными сыворотками крови человека, иммунизированного бактериальной вакциной. Оценить эффективность вакцинации.
2. Протоколировать и оценить результаты РСК, поставленных с парными сыворотками крови человека, иммунизированного вирусной вакциной. Оценить эффективность вакцинации.
3. Протоколировать и оценить результаты РСК, поставленной с сывороткой крови больного с бактериальной инфекцией для дифференциации первичной инфекции и рецидива.
л Методические указания
1. Реакция торможения миграции лейкоцитов. В основе дан
ного метода лежит способность лимфоцитов после повтор
ного контакта с антигеном, к которому они были ранее
сенсибилизированы, продуцировать различные лимфоки-
н ы, в том числе влияющие на миграцию индикаторных кле
ток (гранулоциты, моноциты, макрофаги). Реакция торможе
ния миграции лейкоцитов (РТМЛ) периферической крови в
присутствии причинного антигена позволяет выявить специ
фическую сенсибилизацию Т-лимфоцитов. РТМЛ ставят в ка
пиллярах или под слоем агарозы. Проводят инкубацию лейко
цитов крови в присутствии и в отсутствие причинного мик
робного антигена, после чего измеряют зоны миграции (в про
центах) в присутствии антигена по сравнению с контролем,
принятым за 100 %.
В случае выявления сенсибилизации к антигену наблюдается торможение миграции лейкоцитов (индекс ниже
2. Постановка и оценка кожно-аллергической пробы. Для вы
явления специфической сенсибилизации (при туберкулезе,
 бруцеллезе и других инфекционных заболеваниях) ставят кожно-аллергические пробы. Например, при постановке пробы Манту внутрикожно вводят раствор туберкулина определенной концентрации. Реакцию учитывают через 24—48 ч, оценивая степень выраженности гиперемии и инфильтрат вокруг места введения (рис. 10.4.1; на вклейке). В основе положительной кожной пробы лежит клеточная реакция гиперчувствительности замедленного типа, которая отражает специфическую сенсибилизацию организма к данному инфекционному аллергену. Она возникает в результате текущего, перенесенного заболевания, вакцинации или инфицирования организма.
бруцеллезе и других инфекционных заболеваниях) ставят кожно-аллергические пробы. Например, при постановке пробы Манту внутрикожно вводят раствор туберкулина определенной концентрации. Реакцию учитывают через 24—48 ч, оценивая степень выраженности гиперемии и инфильтрат вокруг места введения (рис. 10.4.1; на вклейке). В основе положительной кожной пробы лежит клеточная реакция гиперчувствительности замедленного типа, которая отражает специфическую сенсибилизацию организма к данному инфекционному аллергену. Она возникает в результате текущего, перенесенного заболевания, вакцинации или инфицирования организма.
3. Выявление нарастания титра антител в серологических реакциях с парными сыворотками больного или вакцинированного. Показателем развития гуморального иммунного ответа является нарастание титра специфических антител в сыворотке крови в течение 3—4 нед после инфицирования или вакцинирования. Это устанавливается в реакции с парными сыворотками, т.е. сыворотками, полученными от одного и того же человека в динамике инфекционного или вакцинального процесса (например, на 1-й и 3—4-й неделе). Появление антител в сыворотке человека, у которого ранее этих антител не было, называется сероконверсией. Диагностическое значение придается, как правило, 4-кратному и более увеличению титра антител.
При бактериальных инфекциях или вакцинации бактериальными вакцинами с парными сыворотками ставят реакции агглютинации, РИГА или РСК (табл. 10.4.1).
Таблица 10.4.1. Результаты развернутой реакции агглютинации с бактериальным диагностикумом и парными сыворотками человека, вакцинированного бактериальной вакциной
| Сроки взятия | Разведения сыворотки | Контроль сыворотки | Контроль диагноста-кума | ||||
| 1:50 | 1:100 | 1:200 | 1:400 | 1:800 | |||
| До вакцинации Через 3 нед после вакцинации | +++ — — — — +++ +++++— — | — | |||||
Таблица 10.4.2. Результаты РСК с диагностикумом вируса гриппа (эпидемический штамм) и парными сыворотками человека, обследованного в период эпидемии гриппа
| Сроки взятия крови |
| Контроль сыворотки |
| Контроль диа-гности-кума |
Разведения сыворотки
1:10 1:20 1:40 1:80 1:160
В самом начале + + — — — — —
эпидемии
Через месяц после + + + + — — —
начала эпидемии
4. Постановка РСК с целью дифференцирования IgM и IgG.
Серологические реакции могут быть использованы для ориентировочного определения принадлежности специфических антител к одному из двух основных изотипов иммуноглобулинов IgM или IgG. Возможность дифференцировать эти два изотипа иммуноглобулинов основана на их различной чувствительности к действию 2-меркаптоэтанола, цистеина и других редуцирующих веществ, которые вызывают разрывы дисульфитных связей в молекулах IgM и их распад на субъединицы, лишенные антительной активности. Под действием той же концентрации 2-меркаптоэтанола молекулы IgG сохраняют свою целостность и антительную активность. Исходя из этого ставят серологическую реакцию (РСК или РТГА) с испытуемой сывороткой: нативной и обработанной 2-меркаптоэтанолом (табл. 10.4.3).
Таблица 10.4.3. Результаты РСК с сывороткой больного, обработанной 2-меркаптоэтанолом (2МЕ), для определения принадлежности антител к IgG или IgM изотипу иммуноглобулинов
| Исследуе- | Разведения сыворотки | ||||||||
| ротка | 1:100 | 1:200 | 1:300 | 1:400 | 1:500 | 1:600 | 1:700 | 1:800 | 1:1000 |
| После обработки 2МЕ Без обработки 2МЕ | + + | + + | + + + + + + | + | + | ||||
При вирусных инфекциях или вакцинации вирусными вакцинами с парными сыворотками ставят РСК, PTIA и реакцию нейтрализации вирусов (табл. 10.4.2).
Нарастание титра антитоксических антител контролируют с помощью реакции флоккуляции или нейтрализации токсина.
При первичной инфекции гуморальный ответ начинается с синтеза IgM, а при рецидиве инфекции на повторную встречу с тем же антигеном иммунная система отвечает преимущественным синтезом IgG.
Снижение титра специфических антител в исследуемой сы-

 воротке в результате обработки 2-меркаптоэтанолом свидетельствует в пользу первичной инфекции.
воротке в результате обработки 2-меркаптоэтанолом свидетельствует в пользу первичной инфекции.
Для определения принадлежности специфических антител к определенному классу (изотипу) иммуноглобулинов используют также твердофазный иммуноферментный метод. Специфический антиген фиксируется на поверхности лунок планшетов из полистирола и инкубируется с исследуемой сывороткой. После отмывания от несвязанных иммобилизованным антигеном белков сыворотки связанные антитела-иммуноглобулины идентифицируются с помощью антиизотипической антиглобу-линовой сыворотки или соответствующих МКАТ. Их связывание в свою очередь устанавливается с помощью антииммуно-глобулиновой сыворотки с ковалентно прикрепленным ферментом.
Глава 11
Часть II
ЧАСТНАЯ МЕДИЦИНСКАЯ МИКРОБИОЛОГИЯ






