Про потребу дріжджів у живильних речовинах роблять висновок по їх хімічному складу, який залежить від живильного середовища, умов культивування дріжджів та їх фізіологічних властивостей. Середній елементарний склад дріжджової клітини (%): вуглець 47, водень 6,5, кисень 31, азот 7,5-10, фосфор 1,6-3,5. Вміст інших елементів незначний (%): кальцію 0,3-0,8, калію 1,5-2,5, магнію 0,1-0,4, натрію 0,06-0,2, сірки 0,2. У дріжджах знайдені мікроелементи (мкг/кг); залізо 90-350, мідь 20-135, цинк 100-160, молібден 15-65.
У пресованих дріжджах міститься 68-76% води і 32-24% сухих речовин. В залежності від стану колоїдів у дріжджовій клітині може бути 46-53% внутрішньоклітинної вологи І 22-27% міжклітинної. При зміні загальної вологості дріжджів змінюється співвідношення між кількістю внутрішньоклітинної І міжклітинної вологи. Видалення 85% води із дріжджів при температурі не вище 50°С майже не впливає на їх життєдіяльність.
Сухі речовини дріжджів складаються із 23-28% органічних речовин і 5-7% золи. Склад органічних речовин такий (%): білку 13-14, глікогену 6-8, целюлози 1,8-2 та жиру 0,5-2.
Білок. Дріжджі містять у собі в середньому 50% сирого білку в перерахунку на сухі речовини і біля 45% істинного (справжнього) білку. У склад сирого білку входять всі сполуки азоту, до яких відносяться похідні нуклеїнових кислот, - пуринові та пірімідінові основи, азот вільних амінокислот.
Глікоген. При відсутності живильних речовин у середовищі глікоген перетворюється в спирт та диоксид вуглецю.
Поряд із глікогеном міститься трегалоза - дуже мобільний резервний вуглевод, який обумовлює стійкість хлібопекарських дріжджів. Вміст трегалози збільшується із зменшенням азоту і при рН нижче 4,5.

------------------------------------------------------------------------------------------ Спиртові дріжджі ---------
Жир. До складу жиру входять в основному олеїнова, ліноленова та пальмітинова кислоти. Він містить 30-40% фосфатидів.
Зола. Зола складається із таких основних оксидів (%): Р2О5 - 25-60, К2О -23-40, СаО - 1-8, MgO - 4-6, Na2O - 0,05-2, SO3 - 0,5-6, SiO2 - 1-2, Fe2O3 - 0,05-0,7.
Фосфор міститься переважно у вигляді органічних і неорганічних орто-, піро-і метафосфатів. Вони входять у склад молекул нуклеїнових кислот, фосфоліпідів та коферментів типу аденозинфосфатів і тіаміну. Так, ядерна речовина клітини (нук-леопротеїди) містить фосфор у вигляді ортофосфату. У вигляді ортофосфату фосфор входить також у склад флавінових ферментів, у вигляді пірофосфату - у багатьох коферментів (кодегідрази  та
та  карбоксил ази). У вигляді різних сполук фосфор бере важливу участь у енергетичних процесах клітини.
карбоксил ази). У вигляді різних сполук фосфор бере важливу участь у енергетичних процесах клітини.
Сірка входить до складу дуже важливих сполук - амінокислот (цистеїн, цис-тин, метіонин та глютатіон) і вітамінів (біотин, аневрин). У ферментах сірка знаходиться у вигляді сульфідних та тіолових груп.
Залізо міститься у цитохромах, цитохромоксидазі, пероксидазі, каталазі та інших ферментах, які беруть участь у процесах дихання. Воно сприяє дії й інших ферментів (зимогеназа, пірофосфатаза).
Магній активує багато фосфатазів та енолазу. Іони магнію впливають на зберігання активності ферментів при нагріванні. Магній і марганець прискорюють засвоювання дріжджами глюкози. Вплив магнію тим більший, чим нижча концентрація глюкози у середовищі. У живильних середовищах повинно міститися 0,02-0,05% магнію у вигляді сульфату. Процеси бродіння регулюються зміною концентрації іонів магнію в результаті приєднання його до органічних речовин.
Калій необхідний не тільки як живильний елемент, а також і як стимулятор розмноження дріжджів. Стимулююча дія пояснюється суттєвою роллю його в окислювальному фосфорилюванні та в процесах гліколізу. Переміщення неорганічного фосфору всередину клітини специфічно стимулюється калієм. Калій активує дріжджову альдолазу, необхідний для дії ферменту піруваткарбоксилази і впливає так само, як і азот та сірка, на ліпідний обмін дріжджових клітин.
Кальцій відіграє роль активатора у мікробній клітині і знаходиться у ній як у вільному стані, так і у зв'язаному - із протеїнами, вуглеводами та ліпідами. іони Са2+ можуть зв'язуватися із АТФ поряд із Mg2+ та Мп2+. Кальцій є кофактором транскето-лази хлібопекарських дріжджів та інгібітором деяких ферментів, наприклад, пірофо-сфотази, енолази та аденозинтрифосфатази. При підвищеному 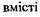 солей кальцію
солей кальцію
пригнічується розмноження дріжджів, знижується накопичення в них глікогену та підвищується вміст стеринів. Так, при вмісті 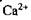 до 40 мг на 1л середовища стимулюється розмноження дріжджів, при більшому вмісті воно пригнічується.
до 40 мг на 1л середовища стимулюється розмноження дріжджів, при більшому вмісті воно пригнічується.
Мікроелементи, Вони мають важливе значення для розмноження та життєдіяльності дріжджів, входячи до складу ферментів, вітамінів та інших сполук, які беруть участь у їх синтезі. Мікроелементи впливають на швидкість та характер різних біохімічних процесів. Наприклад, кобальт стимулює розмноження дріжджів, підвищує вміст у клітинах азотистих речовин небілкової природи, перш за все ДНК, РНК та вільних амінокислот. Він стимулює також синтез вітамінів - ри-

бофлавіна та аскорбінової кислоти. Стимулююча дія мікроелементів пояснюється тим, що вони утворюють із ферментами металоорганічні і внутрішньокомплексні сполуки. Отримуваний ефект залежить від міцності зв'язку ферменту із молекулою субстрату або активування субстрату у проміжному активному комплексі.
Вітаміни та інші фактори росту. Для нормального розвитку і спиртового бродіння дріжджі потребують вітамінів, які є кофакторами багатьох ферментів. Цукро-міцети частково можуть синтезувати всі вітаміни, окрім біотину, який обов'язково повинен бути у живильному середовищі.
Ненасичені жирні кислоти із 18 атомами вуглецю, особливо олеїнова, також є важливими ростовими факторами. Стимулююча дія олеїнової кислоти спостерігається тільки при малій її концентрації, яка не перебільшує 0,5 мг/мл. При збільшенні концентрації ріст дріжджів набагато сповільнюється.
Види і джерела живлення
Розрізняють екзогенне і ендогенне живлення дріжджів: при екзогенному живленні речовини поступають у клітину із зовнішнього середовища, при ендогенному дріжджі використовують (в основному при голодуванні) свої резервні речовини: глікоген, трегалозу, ліпіди, азотисті сполуки.
Вуглецеве живлення. Дріжджі (Saccharomyces cerevisiae) використовують вуглець із різних органічних сполук: глюкози, фруктози (Д-форми), манози, галактози. Пентози Saccharomyces cerevisiae не асимілюють. При відсутності гексоз джерелом вуглецю можуть бути також гліцерин, маніт, етиловий та інші спирти, органічні кислоти (молочна, оцтова, яблучна, лимонна).
Треба враховувати поліауксію - послідовність споживання різних джерел вуглецю. При періодичному культивуванні в першу чергу споживаються глюкоза і фруктоза. Послідовність засвоєння жирних кислот залежить від раси дріжджів та складу цих кислот. Наприклад, оцтова кислота перешкоджає споживанню молочної, а молочна - гліколевій. Оцтова кислота і глюкоза засвоюються одночасно. Як правило, у першу чергу засвоюється із суміші те джерело вуглецю, яке забезпечує більшу швидкість розмноження дріжджів.
При безперервному культивувані дріжджів із збільшенням швидкості розбавлення середовища у ньому залишається більше того вуглецевого компонента, який засвоюється останнім.
Різні види дріжджів неоднаково реагують на асиміляцію одних і тих же речовин. Наприклад, дикі дріжджі Cand. parapsilosis добре споживають галактозу, a Cand. clausseni зовсім її не засвоює. Дріжджі Sacch. cerevisiae починають зброджувати галактозу тільки на другу добу.
Дицукриди, із яких спиртові дріжджі використовують мальтозу і цукрозу, попередньо гідролізуються відповідними ферментами дріжджів до моноцукридів. При переході від анаеробних умов до аеробних послаблюється здатність дріжджів зброджувати глюкозу і мальтозу, а інвертазна активність їх підвищується у 2,5 рази. Дріжджі споживають мальтозу тільки при відсутності у середовищі глюкози і фруктози. Мальтоза зброджується майже повністю під час стаціонарної фази росту дріжджів.

~------ •-------------------------------------------------------------------------------- Спиртові дріжджі--------
Органічні кислоти мають важливе значення у метаболізмі вуглецю, енергетичному обміні мікроорганізмів, у синтетичних та дисимиляційних процесах. Використання кислот жирного ряду як джерел вуглецю залежить від виду і раси дріжджів, концентрації кислоти, довжини її вуглецевого ланцюжка та ступеня електролітичної дисоціації. Добрими субстратами є кислоти із довжиною вуглецевого ланцюжка від С2 до С4 (оцтова, піровиноградна, молочна, масляна та ін.) при порівняно низькій їх концентрації. Калійні солі кислот, які мають у молекулі від 2 до 5 атомів вуглецю, стимулюють ріст дріжджів у 1,4-3,3 раза сильніше у порівнянні із відповідними кислотами.
Жирні кислоти із середньою довжиною вуглецевого ланцюжка (від С6 до 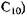 у меншій мірі використовуються дріжджами і тільки при їх дуже низькій концентрації (0,02-0,05%). При більш високій концентрації розвиток дріжджів пригнічується. Жирні кислоти із 12-17 атомами вуглецю в молекулі засвоюються вибірково в залежності від. роду І виду дріжджів.
у меншій мірі використовуються дріжджами і тільки при їх дуже низькій концентрації (0,02-0,05%). При більш високій концентрації розвиток дріжджів пригнічується. Жирні кислоти із 12-17 атомами вуглецю в молекулі засвоюються вибірково в залежності від. роду І виду дріжджів.
Усякий із проміжних продуктів циклу Кребса (піровиноградна, лимонна, янтарна, фумарова, яблучна кислоти) можуть бути єдиним джерелом вуглецю для життєдіяльності дріжджів.
Азотне живлення. Дріжджі можуть синтезувати всі амінокислоти, які входять у склад білка, безпосередньо із неорганічних азотистих речовин при використанні джерелом вуглецю органічних сполук - проміжних продуктів розпаду вуглеводів, які утворюються при диханні і зброджуванні.
Дріжджі Sacch. cerevisiae засвоюють тільки дві форми азоту: аміачний та органічних речовин. Ці мікроорганізми ефективно використовують азот сульфату амонію, сечовини, аміачних солей оцтової, молочної, яблучної і янтарної кислот. У присутності зброджувальних цукрів аміачні солі для дріжджів є джерелом тільки азоту; але ж при використанні його звільняються кислоти, які змінюють рН середовища. Аміачний азот споживається дріжджами краще, ніж азот багатьох амінокислот.
Амінокислоти - одночасно є джерелом азоту і вуглецю, останній засвоюється із кетокислот, які утворюються в результаті відщеплення аміногруп. Можлива і безпосередня асиміляція амінокислот із поживного середовища, яке містить їх повний набір та який-небудь зброджуваний цукор. Внаслідок цього знижуються витрати цукрів на живлення дріжджів і дещо збільшується вихід спирту при зброджуванні. Внаслідок асиміляції амінокислот забезпечується синтез білка, в тому числі І ферментів, активуються деякі ферменти, які уже є у клітинах дріжджів, прискорюється процес брунькування дріжджових клітин.
Для використання органічного азоту (амінокислот, амідів) більшості дріжджам необхідні вітаміни (біотин, пантетенова кислота, тіамін, піридоксин та ін.). Дріжджі не засвоюють такі азотисті сполуки, як білки, бетаїн, холін, пурини й аміни у вигляді етиламіну, пропіл-і бутиламіну. Пептиди займають середню позицію між амінокислотами і білками.
Використання дріжджами пептидів зменшується із підвищенням їх складності. Деяка кількість пептидів у середовищі поряд з іншими формами азоту сприяє засвоєнню амінокислот.

На утворення 10 млрд дріжджових клітин витрачається азоту в умовах анаеробіозу 66-77 мг, в умовах аеробіозу 37-53 мг. Про умови культивування та фізіологічний стан дріжджів можна довідатися з вмісту у них азоту, що залежить від складу середовища, кількості додатково введених живильних речовин та від раси дріжджів. У дріжджах, одержаних на спиртових заводах, міститься загального азоту 7-10% (інколи до 12%) на сухі речовини.
Фосфорне живлення. В анаеробних умовах дріжджі засвоюють фосфор головним чином у початковий період зброджування - 80-90% від максимальної кількості у дріжджах. Молоді дріжджі, які енергійно розмножуються, більш багаті фосфором у порівнянні з дріжджами старими, які не брунькуються. Наприклад, після 6 годин бродіння дріжджі містять 2,15% фосфору на сухі речовини, а в кінці бродіння -тільки 1%.
У суслі із крохмалевмісної сировини є достатня кількість фосфорвмісних сполук, які засвоюються дріжджами, а у мелясному суслі їх недостатньо і необхідно додавати ортофосфорну кислоту, або Інші джерела фосфорного живлення.
ІНШІ ФАКТОРИ
Швидкість розмноження дріжджів залежить від різниці осмотичного тиску у дріжджовій клітині й у суслі: чим вона більша, тим швидше розмножуються дріжджі. Внаслідок цього дріжджі мають більш активний фізіологічний стан при зброджуванні меляси двохпотоковим способом у порівнянні із 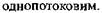
Якщо спиртові дріжджі оброблені ультразвуком, то активність інвертази у них зростає у декілька разів і в деяких випадках стимулюється їх швидкість росту. Дією на хлібопекарські дріжджі ультразвуку частотою 425 кГц протягом 1 години підвищується їх бродильна енергія і підйомна сила на 15-18%; при частоті 380 і 740 кГц вміст ергостерину підвищується на 45-60%.
Під впливом  у винних дріжджів підвищується бродильна, у хлі-
у винних дріжджів підвищується бродильна, у хлі-
бопекарських - мальтазна активність. Після опромінення ультрафіолетовими променями дріжджі втрачають здатність синтезувати лейцин, ізолейцин та валін. Так були отримані мутанти, які не утворюють ізоамілового та Ізобутилового спиртів. Після обробки хлібопекарських дріжджів ультрафіолетовим промінням та етиленІ-міном одержані мутанти, мальтозна активність яких у 2-5 разів вища, ніж контрольних дріжджів.
Спирти, ефіри і слабі розчини лугів розчиняють ліпоїдні речовини дріжджових клітин. Спирти навіть у невеликих концентраціях (3-4%) затримують брунькування дріжджів. Проте в безперервному потоці зброджувального середовища дріжджі здатні розмножуватися при відносно високій концентрації спирту (7-8 об.%) і продовжують зброджувати цукри до концентрації спирту 11-12 об.%. Розмноження дріжджів при безперервному зброджуванні залежить головним чином від вмісту живильних речовин і менше від концентрації спирту у бражці.
Формалін, кислоти і солі важких металів належать до плазматичних отрут. Невелика кількість формаліну (0,09%) порушує нормальну життєдіяльність дріж-

------------------------------------------------------------------------------------------ Спиртові дріжджі -----------
джів, а доза 0,001% гальмує їх брунькування. Часто дози речовин, які знижують бродильну енергію дріжджів, значно вищі тих, що затримують брунькування.
Сульфітна, азотиста і фтористоводнева кислоти та їх солі у дуже малих концентраціях перешкоджають нормальному росту дріжджів: діоксид сірки при концентрації 0,0025%, нітрити - 0,0005%. Якщо в мелясі міститься 0,02% діоксиду сірки, то якість дріжджів значно погіршується - вони швидко темніють, знижуються їх підйомна сила та стійкість при зберіганні.
У розчинах сірчаної кислоти концентрацією 0,35-0,6% через 15 хв усі клітини дріжджів зберігають життєдіяльність, через 24 години нараховують тільки 2% мертвих клітин. Молочнокислі бактерії у 0,15%-ному розчині сірчаної кислоти уже через 2 години гинуть, а у 0,5%-ному розчині протягом такого ж часу гинуть усі бактерії. Дикі дріжджі можуть витримувати дію 1,3%-ного розчину сірчаної кислоти протягом 2 годин.
Вільні органічні кислоти спричиняють на дріжджі більшу інгібуючу дію, ніж їх солі. Леткі органічні кислоти навіть у незначних концентраціях пригнічують розмноження дріжджів та прискорюють їх відмирання. Найбільш сильні інгібітори - масляна і капронова кислоти. Особливо чутливі дріжджі до летких органічних кислот при зниженні рН середовища до 4. У цих умовах через добу у дріжджовій популяції спостерігають велику кількість плазмолІзованих клітин та бруньок.
У випадку великого засіву (120-150 млн. клітинна 1 мл)  бражки 5,1 коефіцієнт розмноження дріжджів раси В у контрольному варіанті 2,1, а у випадку, коли вміст масляної кислоти 0,02% - 1,2, капронової 0,02% - 1,15. Кількість мертвих клітин дріжджів рас В і Я складала 21-52%. У присутності пропіонової кислоти коефіцієнт розмноження дріжджів рас В і Я в 1,5, а кількість мертвих клітин - у 2 рази менша, ніж у контрольному варіанті.
бражки 5,1 коефіцієнт розмноження дріжджів раси В у контрольному варіанті 2,1, а у випадку, коли вміст масляної кислоти 0,02% - 1,2, капронової 0,02% - 1,15. Кількість мертвих клітин дріжджів рас В і Я складала 21-52%. У присутності пропіонової кислоти коефіцієнт розмноження дріжджів рас В і Я в 1,5, а кількість мертвих клітин - у 2 рази менша, ніж у контрольному варіанті.
Мурашина кислота знижує коефіцієнт розмноження дріжджів, але не викликає відмирання клітин. Оцтова кислота порівняно слабкий інгібітор.
Під час зброджування синтетичного середовища Рідер із 13% цукрози дріжджами рас В і Я спостерігають зниження виходу спирту при таких концентраціях летких органічних кислот у зброджувальному середовищі (%): масляної 0,045, капронової 0,055, мурашиної 0,09, пропіонової 0,12 і оцтової 0,45. У цих же умовах не знижується спиртоутворення у дріжджів Г-176 і Г-202. Вказаним концентраціям кислот у 22%-ному мелясному суслі відповідає такий їх вміст у мелясі (%): масляної 0,2, капронової 0,5 і оцтової 2,0. У більшості випадків у мелясі органічних кислот значно менше, і тільки Інколи вміст мурашиної і пропіонової кислот близький до концентрацій, при яких знижується вихід спирту.
У присутності масляної і капронової кислот процес утворення вищих спиртів у значній мірі блокується незалежно від раси дріжджів.
Деякі важкі метали у дуже малих концентраціях вбивають дріжджові клітини (срібло - 0,000001; мідь - 0,005%), а при концентраціях, які не визначаються хімічним аналізом, гальмують ріст дріжджів. Бактерицидна дія важких металів залежить від складу середовища, його кислотності, температури і густини дріжджової

популяції. Наприклад, солі міді у кислих середовищах більш отруйні, солі срібла виявляють більш сильну бактерицидну дію у вигляді аміачних розчинів.
У випадках присутності фурфурола у зброджувальному середовищі зменшується кількість клітин, що брунькуються, і їх розмір. Навіть при незначному вмісті фурфуролу знижується мальтазна та зимазна активність виділених із дозрілої мелясної бражки дріжджів.
Сульфонол у невеликих концентраціях (70-100 г на 1 т меляси) не впливає на життєдіяльність дріжджів і пригнічує молочнокислу мікрофлору. Хлор, хлорне вапно, марганцевокислий калій сильно окислюють органічні речовини і руйнують їх.
У бражці із підвищеним вмістом іонів Са, Mg, Fe у дріжджових клітинах втрачається водна оболонка, у зв'язку з чим зменшується іонна сфера та електричний заряд на поверхні клітин і створюються умови для аглютинації дріжджів.
Спиртові раси дріжджів мають від'ємний електрокінетичний потенціал: від -7 до -13 мВ, внаслідок чого вони адсорбують на своїй поверхні меланоїдини з позитивним потенціалом. Якщо рН середовища знижується, електрокінетичний потенціал меланоїдинів підвищується і в зв'язку з цим збільшується ступінь адсорбції їх на дріжджових клітинах. Меланоїдини надають дріжджам темного кольору, сприяють відмиранню дріжджових клітин і зниженню їх ферментативної активності, зокрема активності інвертази і каталази. Якщо у забродженому середовищі міститься від 0,005 до 0,3 г меланоїдинів у 100 мл, то через 24 години популяція дріжджів зменшується в 1,3-2 рази.
Десорбція забарвлених речовин із поверхні дріжджової клітини проходить інтенсивно при рН промивної води вище 9. При рН біля 3 забарвлені речовини не десорбуються.
Багато які ферменти дріжджів активуються у присутності незначної кількості сульфігідрильних сполук, які мають SH-групи, таких як цистеїн, глютатіон. Ці сполуки легко перетворюються одна в іншу, мають важливе значення в активуванні та регулюванні багатьох окисно-відновних і гідролітичних ферментів, які визначають життєдіяльність та обмінні процеси мікроорганізмів.
SH-групи відіграють важливу роль у ланцюгу окисно-відновних реакцій і є необхідною ланкою у передачі електрона від суксинату до кисню повітря через цитохром. Активність багатьох дегідрогеназ, флавінових І піридоксинових ферментів зв'язана із наявністю у молекулі вільних SH-rpyn.
Відновлений глютатіон і цистеїн прискорюють спиртове бродіння внаслідок того, що SH-групи тіолових ферментів відновлюються і ці ферменти беруть участь у аеробному і анаеробному окисленні цукрів. Але застосування цих дорогих речовин економічно недоцільно, а їх замінником може бути використаний дріжджовий автолізат.

БІОХІМІЯ БРОДІННЯ ТА ДИХАННЯ АНАЕРОБНИЙ РОЗПАД ВУГЛЕВОДІВ
Ферментативна дисиміляція вуглеводів в анаеробних умовах, яка проходить із виділенням енергії і приводить до утворення продуктів неповного окислення, називається бродінням. У цьому процесі акцептором водню є органічні сполуки, які утворюються в реакціях окислення (наприклад, оцтовий альдегід при спиртовому бродінні); кисень у цих реакціях не бере участь.
Схема хімічних перетворень під час спиртового бродіння глюкози подана на рис. 6.1.
1. Утворюються фосфорні ефіри цукрів. Під дією ферменту гексокінази та
аденілових кислот, які є донорами і акцепторами фосфорної кислоти, глюкоза пе
ретворюється у глюкопіранозо-6-фосфат. Аденілові кислоти у дріжджах містяться
у вигляді аденозинтрифосфату (АТФ). Гекзокіназа каталізує перенесення однієї фо
сфорної групи із АТФ на глюкозу. При цьому АТФ перетворюється у АДФ, а зали
шок фосфорної кислоти приєднується у місці шостого атома вуглецю. Дія ферме
нту активується ^іонами магнію. Схоже проходить перетворення Д-фруктози і Д-
манози. Глюкокіназна реакція визначає швидкість процесу бродіння.
2. Глюко-6-фосфат під дією ферменту глюкозофосфатізомерази ізомеризується
- перетворюється у фруктозо-6-фосфат. Реакція зворотня і зсунута в бік фруктозо-
6-фосфату.
3. Фруктозо-6-фосфат під дією ферменту фосфофруктокінази приєднує у міс
ці першого атома вуглецю другий залишок фосфорної кислоти за рахунок АТФ і
перетворюється у фруктозо-1,6-дифосфат. Ця реакція практично незворотня. Мо
лекула цукру переходить у оксоформу і стає лабільною, здатною до подальшого
перетворення, бо послаблюється зв'язок між третім і четвертим атомами вуглецю.
4. Під дією ферменту альдолази, яка активується іонами Zn2+, Co2+ та Са2+,
фруктозо-1,6-дифосфат розпадається на дві фосфотриози - 3-фосфогліцериновий
альдегід та фосфодіоксиацетон. Ця реакція зворотня.
5. Поміж фосфотриозами відбувається реакція ізомеризації, яка каталізується
ферментом триозофосфатізомеразою. Рівновага встановлюється при 95% 3-фос-
фогліцеринового альдегіду і 5% фосфодіоксиацетону.
6. В індукційний період, поки ще не утворився оцтовий альдегід, як проміж
ний продукт, поміж двома молекулами 3-фосфогліцеринового альдегіду під дією
ферменту альдегідмутази за участі молекули води проходить реакція дисмутації.
При цьому одна молекула фосфогліцеринового альдегіду відновлюється, утворюючи фосфоглІцерин, інша окислюється у 3-фосфогліцеринову кислоту. Фосфог-ліцерин у подальших реакціях участі не бере і після відщеплення фосфорної кислоти є побічним продуктом спиртового бродіння.
Під час сталого процесу окислення 3-фосфогліцеринового альдегіду у 3-фосфогліцеринову кислоту проходить складним шляхом. Спочатку він перетворюється в 1,3-дифосфогліцериновий альдегід, приєднуючи залишок неорганічної фосфорної кислоти, потім під дією ферменту триозофосфатдегідрогенази у присутності
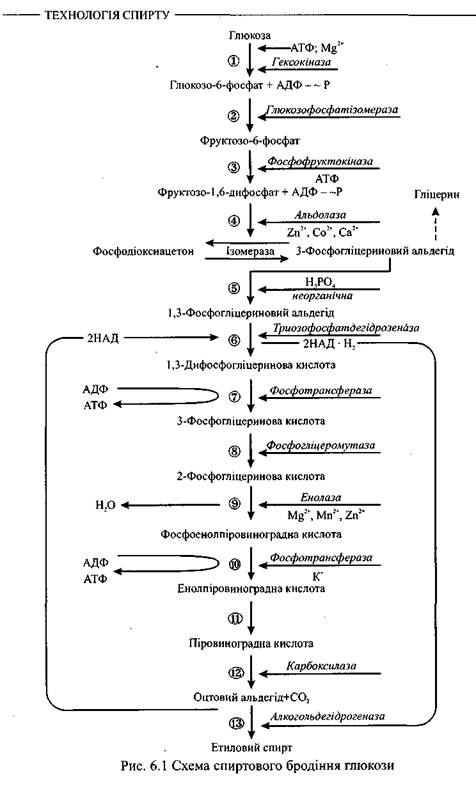

НАД (нікотинамідадєніндинуклеотиду) окислюється в 1,3-Дифосфогліцеринову кислоту. НАД, яка вступає у сполуку із специфічним білком, утворює анаеробну дегідрогеназу, яка має здатність віднімати водень безпосередньо від фосфогліцери-нового альдегіду та інших органічних сполук.
7. За допомогою ферменту фосфотрансферази залишок фосфорної кислоти,
який містить макроергічний зв'язок, передається із 1,3-дифосфогліцеринової кис
лоти на АДФ з утворенням АТФ та 3-фосфогліцеринової кислоти. Енергія, яка зві
льнюється при окисленні фосфогліцеринового альдегіду, резервується в АТФ.
8. Під дією ферменту фосфогліцеромутази 3-фосфогліцеринова кислота ізо
меризується у 2-фосфогліцеринову кислоту.
9. У результаті віддачі води, внаслідок перерозподілу внутрішньомолекуляр-
ної енергії, 2-фосфогліцеринова кислота перетворюється у фосфоенолпіровиног-
радну кислоту, яка має мікроергічний зв'язок. Реакцію каталізує енолаза, яка акти
вується іонами Mg2+, Mn2+, Zn2+. Максимальна дія енолази виявляється в інтервалі
рН 5,2-5,5. При рН 4,2 молекули енолази агрегуються, а при рН 3-4 незворотньо
денатуруються.
10. Під дією ферменту фосфотрансферази у присутності іонів К+ залишок фо
сфорної кислоти передається від фосфоенолпіровиноградної кислоти на АДФ, ене
ргія при цьому резервується у АТФ.
11. Утворена енолпіровиноградна кислота перетворюється у більш стабільну
кетоформу.
12. Під дією ферменту карбоксилази від піровиноградної кислоти відщеп
люється діоксид вуглецю і утворюється оцтовий альдегід.
13. Фермент алкогольдегідрогеназа переносить водень із відновленого
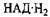 на оцтовий альдегід, в результаті чого утворюється етиловий спирт і реге
на оцтовий альдегід, в результаті чого утворюється етиловий спирт і реге
нерується НАД.






