9.1. Обчислити кількість теплоти 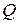 , отриману рівноважним випромінюванням при ізотермічному розширенні від об’єму
, отриману рівноважним випромінюванням при ізотермічному розширенні від об’єму  до об’єму
до об’єму  (при температурі
(при температурі 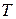 ), користуючись або лише першим, або лише другим началом термодинаміки.
), користуючись або лише першим, або лише другим началом термодинаміки.
9.2. Завдяки еквівалентності маси та енергії поряд із перетворенням речовини на випромінювання можливий також зворотний процес перетворення випромінювання на речовину. Визначити температуру, при якій виникає пара електрон–позітрон у рівноважній системі електронний газ – випромінювання.
9.3. Показати, що рівноважне випромінювання є стійкою термодинамічною системою.
9.4. Показати, що якби спектральна густина енергії випромінювання 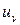 залежала б від речовини стінок порожнини, то можна було б створити вічний двигун другого роду.
залежала б від речовини стінок порожнини, то можна було б створити вічний двигун другого роду.
9.5. Записати основні рівняння термодинаміки діелектриків, коли незалежними (електричними) величинами виступають  ,
,  ,
, 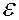 .
.
9.6. Отримати рівняння для диференціалів термодинамічних потенціалів діелектриків у випадку, коли елементарна робота поляризації одиниці об’єму діелектрика має вигляд 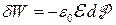 .
.
9.7. Знайти магнітокалоричний ефект 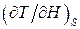 для речовин, магнітна сприйнятливість яких задовольняє закону Кюрі–Вейса:
для речовин, магнітна сприйнятливість яких задовольняє закону Кюрі–Вейса: 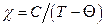 , де
, де 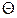 – парамагнітна точка Кюрі.
– парамагнітна точка Кюрі.
9.8. Обчислити роботу на одиницю об’єму, яку виконує за цикл перемагнічування феромагнітне осердя довгого соленоїда, якщо відомо, що площа петлі гістерезису осердя на діаграмі з осями координат  ,
,  дорівнює
дорівнює  .
.
9.9. Знайти вільну енергію  і ентропію
і ентропію  як функції намагніченості
як функції намагніченості  та температури
та температури 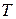 для парамагнетика з магнітною сприйнятливістю
для парамагнетика з магнітною сприйнятливістю  .
.
Розділ 10
НЕРІВНОВАЖНА ТЕРМОДИНАМІКА
Теоретичні відомості
Вступ. Світ, в якому ми живемо, з термодинамічної точки зору є суттєво нерівноважним, оскільки всі природні процеси відбуваються із скінченою швидкістю. Це забезпечується відкритістю нашого світу (як багаточастинкової системи) до постійного притоку сонячної енергії.
Найбільш повною і глибокою теорією необоротних, а значить і нерівноважних процесів може бути лише статистична теорія. Вона повинна пояснювати всі макроскопічні закономірності нерівноважних систем. Але ця програма до кінця не вирішена. Проте в останні десятиріччя побудована саме термодинаміка необоротних явищ як узагальнення рівноважної термодинаміки.
Нерівноважна термодинаміка вивчає найбільш характерні необоротні процеси переносу маси, енергії, електричного заряду тощо. Для таких процесів завжди можна виділити причину (термодинамічну силу) і наслідок (термодинамічний потік), які пов’язані тим чи іншим фізичним законом. Наприклад, для процесу теплопровідності це відповідно градієнт температури і потік кількості теплоти, які лінійно пов’язані законом Фур’є. Якщо говорити в цілому, подібна лінійність виявляється за умови малих відхилень від станів рівноваги (лінійний режим). У системах, далеких від рівноваги, потоки вже не є лінійними функціями термодинамічних сил, але в цих умовах, як показують досліди, можливі особливі стійкі та високоорганізовані стани. Ця обставина вказує на певну дуалістичність необоротних процесів, які руйнують порядок поблизу рівноваги і створюють його удалині від рівноваги. В останньому випадку перехід до упорядкованого стану можливий навіть у результаті достатньо великих флуктуацій. Такі суттєво нерівноважні, але високоорганізовані стани називаються дисипативними структурами. Вони виявлені в різноманітному колі фізичних явищ.
Локальна рівновага і основне рівняння термодинаміки нерівноважних процесів. При узагальненні класичної рівноважної термодинаміки на нерівноважні процеси виходять з уявлення (принципу) про локальну рівновагу. Цей принцип випливає з відомого природного факту, згідно з яким час релаксації зростає із зростанням розміру системи, так що окремі макроскопічні її частини (ділянки) приходять до рівноважного стану раніш, ніж встановлюється рівновага між самими частинами. Тому в нерівноважній термодинаміці приймається, що, хоча стан системи в цілому не є рівноважним, проте окремі її малі ділянки приблизно рівноважні (квазірівноважні) і мають параметри, які повільно змінюються з часом та від точки до точки. Очевидно, що такі малі частини системи повинні містити досить велике число частинок, тобто бути макроскопічними, інакше природні флуктуації не дозволять визначити той чи інший термодинамічний параметр. Таке трапиться, коли абсолютна флуктуація параметра стане порівнянною з самим значенням цього параметра. Отже, лінійний розмір 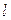 зазначених ділянок повинен задовольняти умові забезпечення макроскопічності:
зазначених ділянок повинен задовольняти умові забезпечення макроскопічності: 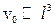 , де
, де  - об’єм, що припадає на одну частинку.
- об’єм, що припадає на одну частинку.
З іншого боку, неоднорідності термодинамічних параметрів ai (r)  протягом довжини
протягом довжини 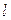 повинні бути малими в порівнянні зі значеннями самих параметрів, інакше такі ділянки не можна вважати квазірівноважними. Математично цю умову можна записати як
повинні бути малими в порівнянні зі значеннями самих параметрів, інакше такі ділянки не можна вважати квазірівноважними. Математично цю умову можна записати як 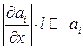 , де
, де  – координата вздовж довільно вибраної вісі. Об’єднуючи останні дві нерівності, матимемо
– координата вздовж довільно вибраної вісі. Об’єднуючи останні дві нерівності, матимемо
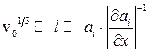 . (10.1)
. (10.1)
Для часів t зміни значень аі в цих ділянках також можна записати:
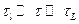 , (10.2)
, (10.2)
де 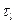 і
і 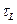 - часи релаксації самої ділянки та всієї системи відповідно.
- часи релаксації самої ділянки та всієї системи відповідно.
Виконання умов (10.1), (10.2) дозволяє увести припущення про локальну рівновагу для конкретної системи з подальшою побудовою послідовної термодинамічної теорії необоротних процесів. Отже, в цій теорії стан нерівноважної системи повинен описуватися саме локальними термодинамічними потенціалами, які в свою чергу залежать від координат та часу через свої характеристичні змінні.
Через суттєву важливість у нерівноважній термодинаміці ентропії 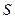 саме її локальну величину (віднесену до одиниці маси)
саме її локальну величину (віднесену до одиниці маси) 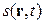 розглядають як функцію локальних величин
розглядають як функцію локальних величин 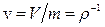 (питомий об’єм),
(питомий об’єм), 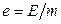 (питома внутрішня енергія),
(питома внутрішня енергія), 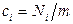 (питома кількість частинок i -го компонента):
(питома кількість частинок i -го компонента): 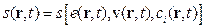 . При цьому
. При цьому 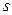 визначається з аналога основного рівняння рівноважної термодинаміки, але для локальних (питомих) величин:
визначається з аналога основного рівняння рівноважної термодинаміки, але для локальних (питомих) величин:
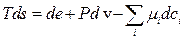 (10.3)
(10.3)
або в узагальненому вигляді
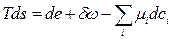 (10.4)
(10.4)
де  - питома робота, яка може складатися з декількох доданків. Рівняння (10.3) чи (10.4) називають основним рівнянням нерівноважної термодинаміки.
- питома робота, яка може складатися з декількох доданків. Рівняння (10.3) чи (10.4) називають основним рівнянням нерівноважної термодинаміки.
Утворення ентропії. Часто локальну ентропію розглядають як величину 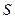 , яка припадає на одиницю об’єму, тобто
, яка припадає на одиницю об’єму, тобто 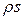 , де
, де  - густина маси. Це дозволяє розраховувати ентропію всієї системи шляхом прямого додавання (інтегрування) її об’ємних частин:
- густина маси. Це дозволяє розраховувати ентропію всієї системи шляхом прямого додавання (інтегрування) її об’ємних частин:
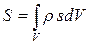 . (10.5)
. (10.5)
Для нерівноважної термодинаміки важливою характеристикою є швидкість  виникання ентропії в одиниці об’єму адіабатної системи. Отже, при необоротному процесі, враховуючи залежність
виникання ентропії в одиниці об’єму адіабатної системи. Отже, при необоротному процесі, враховуючи залежність 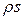 від термодинамічних параметрів
від термодинамічних параметрів 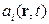 , можна записати
, можна записати
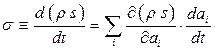 . (10.6)
. (10.6)
Величину  називають утворенням ентропії.
називають утворенням ентропії.
З (10.6) можна побачити, що  складається з різних доданків, кожен з яких відповідає своєму параметру
складається з різних доданків, кожен з яких відповідає своєму параметру 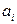 . Прийнято називати фактор
. Прийнято називати фактор 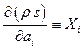 термодинамічною силою, а фактор
термодинамічною силою, а фактор 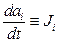 - термодинамічним потоком (током), що відповідають параметру
- термодинамічним потоком (током), що відповідають параметру 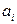 . Отже, (10.6) можна зобразити у вигляді
. Отже, (10.6) можна зобразити у вигляді
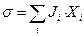 , (10.7)
, (10.7)
тобто утворення ентропії  має білінійну форму за потоками
має білінійну форму за потоками 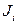 та силами
та силами 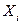 .
.
Зазначимо, що потоки J можуть протікати в просторових координатах (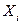 при цьому є компонентами відповідних градієнтів) або в координатах складів
при цьому є компонентами відповідних градієнтів) або в координатах складів  (хімічні реакції). В першому випадку індекс і нумерує просторові компоненти векторів J, а в другому - сорт частинок системи.
(хімічні реакції). В першому випадку індекс і нумерує просторові компоненти векторів J, а в другому - сорт частинок системи.
Рівняння балансу. Визначення утворення ентропії. Для надання правій частині (10.6) більш конкретного термодинамічного вигляду треба залучити основне рівняння (10.3). Однак цього виявляється замало, оскільки для кожного екстенсивного параметра, скажімо  , існує співвідношення, яке обмежує швидкість зміни його локальної величини
, існує співвідношення, яке обмежує швидкість зміни його локальної величини 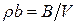 з часом:
з часом:
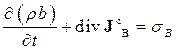 . (10.8)
. (10.8)
Це - загальнофізичне рівняння неперервності з правою частиною 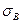 , яка в нашому випадку має зміст зміни
, яка в нашому випадку має зміст зміни 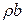 з часом за рахунок локальних джерел величини
з часом за рахунок локальних джерел величини  .
.  означає збереження цієї величини.
означає збереження цієї величини.  є густиною повного потоку параметра
є густиною повного потоку параметра  , тобто кількістю
, тобто кількістю  , що перетинає одиницю площі поверхні (в проекції на нормаль до поверхні) за одиницю часу. Конвективна частина
, що перетинає одиницю площі поверхні (в проекції на нормаль до поверхні) за одиницю часу. Конвективна частина 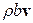 густини повного потоку
густини повного потоку 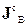 відповідає за перенос величини
відповідає за перенос величини  разом з потоком речовини, швидкість якої дорівнює
разом з потоком речовини, швидкість якої дорівнює 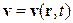 . Неконвективна частина
. Неконвективна частина 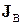 не пов’язана з переносом речовини (тепловий потік, дифузійний потік тощо).
не пов’язана з переносом речовини (тепловий потік, дифузійний потік тощо).
У термодинаміці рівняння (10.8) називають локальним диференціальним рівнянням балансу для параметра  . В окремому випадку, коли
. В окремому випадку, коли  , маємо:
, маємо:  ,
, 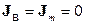 ,
, 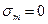 (збереження маси) і (10.8) набирає вигляду
(збереження маси) і (10.8) набирає вигляду
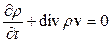 . (10.9)
. (10.9)
Використовуючи (10.9), рівняння балансу (10.8) можна привести до еквівалентного вигляду
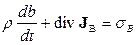 , (10.10)
, (10.10)
але який дозволяє зразу одержати утворення ентропії для того чи іншого процесу. (10.10) називають субстанціональним диференціальним рівнянням балансу для величини  . При
. При 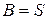 матимемо
матимемо
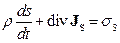 . (10.11)
. (10.11)
Отже, як приклад, знайдемо утворення ентропії 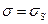 у процесі теплопровідності в однорідному твердому тілі. У цьому випадку можна покласти
у процесі теплопровідності в однорідному твердому тілі. У цьому випадку можна покласти 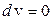 (знехтування тепловим розширенням),
(знехтування тепловим розширенням), 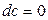 (відсутність потоків частинок), тому основне рівняння (10.3) матиме вигляд
(відсутність потоків частинок), тому основне рівняння (10.3) матиме вигляд
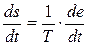 . (10.12)
. (10.12)
З рівняння балансу (10.10) для 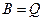 (кількість теплоти) за законом збереження енергії (
(кількість теплоти) за законом збереження енергії (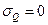 ) можна записати
) можна записати
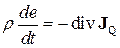 , (10.13)
, (10.13)
де 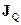 - густина потоку кількості теплоти. З останніх двох рівнянь одержуємо
- густина потоку кількості теплоти. З останніх двох рівнянь одержуємо
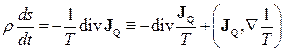 . (10.14)
. (10.14)
Зіставляючи рівняння (10.14) і (10.11), знаходимо, що густина потоку ентропії J S і утворення ентропії 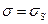 відповідно дорівнюють
відповідно дорівнюють
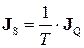 , (10.15)
, (10.15)
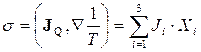 , (10.16)
, (10.16)
де 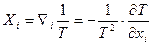 - і -та компонента термодинамічної сили, яка відповідає компоненті потоку Ji.
- і -та компонента термодинамічної сили, яка відповідає компоненті потоку Ji.
Використовуючи закон теплопровідності Фур’є  (
( - коефіцієнт теплопровідності), з (10.16) отримуємо
- коефіцієнт теплопровідності), з (10.16) отримуємо
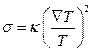 , (10.17)
, (10.17)
що відповідає другому началу термодинаміки, згідно з яким 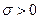 .
.
Зазначимо, що математичний розподіл правої частини (10.14) на -  і джерело ентропії
і джерело ентропії  не є однозначним. Однозначність досягається фізичними вимогами:
не є однозначним. Однозначність досягається фізичними вимогами: 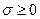 та інваріантністю виразу (10.16) відносно перетворень Галілея.
та інваріантністю виразу (10.16) відносно перетворень Галілея.
Аналогічно до розглянутого випадку основне рівняння (10.3) дозволяє одержати утворення ентропії  для інших нерівноважних систем у станах локальної рівноваги. Додаючи до розглянутого процесу теплопровідності такі важливі процеси, як дифузія, електропровідність, хімічні реакції, вираз (10.16) можна записати в розширеному вигляді:
для інших нерівноважних систем у станах локальної рівноваги. Додаючи до розглянутого процесу теплопровідності такі важливі процеси, як дифузія, електропровідність, хімічні реакції, вираз (10.16) можна записати в розширеному вигляді:
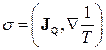
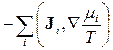
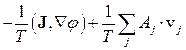 , (10.18)
, (10.18)
де J i - густина дифузійного потоку i -го сорту частинок, mi - відповідний хімічний потенціал, J - густина іонного струму, 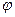 - електричний потенціал, Aj - так звана хімічна спорідненість j -ої реакції,
- електричний потенціал, Aj - так звана хімічна спорідненість j -ої реакції, 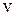 j - швидкість j -ої реакції, яка грає роль відповідного потоку.
j - швидкість j -ої реакції, яка грає роль відповідного потоку.
Лінійний режим. Співвідношення взаємності Онсагера. В станах рівноваги усі термодинамічні сили і залежні від них потоки дорівнюють нулю. Для малих відхилень сил від своїх рівноважних (нульових) значень природно припустити, що потоки є лінійними функціями сил. При цьому говорять про лінійний режим необоротних процесів і записують
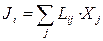 . (10.19)
. (10.19)
Сталі величини Lij називають кінетичними (феноменологічними) коефіцієнтами. Запис (10.19) підкреслює, що різні сили можуть призводити до одного і того ж потоку (так саме різні потоки можуть викликатися однією силою). Наприклад, густина потоку маси J 1 при наявності градієнтів концентрації і температури дорівнює
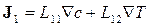 .
.
Діагональні коефіцієнти Lii визначають “прямі” явища переносу, а недіагональні коефіцієнти Lij (i¹ j) - “перехресні” (спряжені) процеси. Добре відомі та вивчені такі спряжені процеси, як у ефектах Зеєбека (поява ЕРС в колі з двох різнорідних провідників, коли їх з’єднання знаходяться при різних температурах) і Пельтьє (електричний струм у такому колі спричиняє тепловий потік від одного з’єднання до іншого).
Отже, в умовах лінійного режиму, маючи на увазі (10.19), утворення ентропії (10.7) матиме вигляд
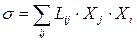 . (10.20)
. (10.20)
Згідно з другим началом квадратична форма (10.20) повинна бути додатно означеною, що накладає певні обмеження на коефіцієнти Lij. Крім того Ларсом Онсагером (1931 р.) у межах статистичного підходу були встановлені співвідношення, які носять його ім’я, - співвідношення взаємності Онсагера:
Lij = Lji, (10.21)
тобто в умовах лінійності матриця кінетичних коефіцієнтів симетрична. Існує також правило (принцип Кюрі), згідно з яким виключається спряженість між силами і потоками різної тензорної вимірності. Так, скажімо, скалярна термодинамічна сила - хімічна спорідненість не може викликати тепловий потік, який є векторною величиною. В цих випадках відповідні кінетичні коефіцієнти дорівнюють нулю.
Основне рівняння нерівноважної термодинаміки (10.3) або його наслідок (10.18) разом із співвідношеннями (10.21) дозволяють у межах лінійного режиму встановити загальні зв’язки між кінетичними коефіцієнтами різноманітних процесів переносу.
Термоелектричні явища: ефект Зеєбека, ефект Пельтьє. Як ілюстрацію застосування нерівноважної термодинаміки в лінійному режимі разом із співвідношеннями Онсагера розглянемо два вже згадувані спряжені процеси в ефектах Зеєбека та Пельтьє. Нашим завданням буде встановлення усіх відповідних кінетичних коефіцієнтів.
Отже, нехай у колі із з’єднаних різнорідних провідників мають місце потік кількості теплоти з густиною 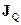 та потік електронів з густиною
та потік електронів з густиною 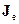 (густина електричного струму). Для цього випадку утворення ентропії
(густина електричного струму). Для цього випадку утворення ентропії  містить лише перший та третій доданки з правої частини (10.18):
містить лише перший та третій доданки з правої частини (10.18):
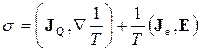 , (10.22)
, (10.22)
де 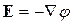 - напруженість електричного поля. В одновимірному провіднику з поздовжньою координатою x лінійні співвідношення (10.19) набувають скалярного вигляду
- напруженість електричного поля. В одновимірному провіднику з поздовжньою координатою x лінійні співвідношення (10.19) набувають скалярного вигляду
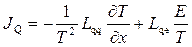 , (10.23)
, (10.23)
 . (10.24)
. (10.24)
Закон теплопровідності Фур’є 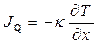 правильний, якщо відсутнє електричне поле (
правильний, якщо відсутнє електричне поле (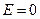 ). Порівнюючи в цьому випадку (10.23) з законом Фур’є, одержуємо
). Порівнюючи в цьому випадку (10.23) з законом Фур’є, одержуємо
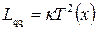 . (10.25)
. (10.25)
Однак, при лінійному режимі коефіцієнти Lij повинні бути сталими, що суперечить (10.25). Щоб уникнути цієї суперечності, треба більш точно визначити, що означає близький до рівноваги лінійний режим. Таким є режим, коли можна знехтувати зміною температури від одного з’єднання провідників до іншого у порівнянні з їх середньою температурою T c, тобто повинна виконуватись нерівність  . Тоді з урахуванням
. Тоді з урахуванням 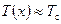 вважатимемо у (10.25):
вважатимемо у (10.25):
 . (10.26)
. (10.26)
Щоб знайти другий “прямий” кінетичний коефіцієнт L ee, візьмемо до уваги, що при сталій температурі 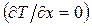 електричний струм цілком визначається ЕРС
електричний струм цілком визначається ЕРС 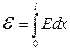 , де
, де 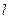 - довжина системи провідників. Отже, інтегруючи (10.24) за довжиною системи, отримуємо
- довжина системи провідників. Отже, інтегруючи (10.24) за довжиною системи, отримуємо
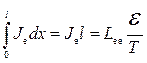 ,
,
звідки, враховуючи, що питомий опір провідників 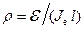 , знайдемо
, знайдемо
 . (10.27)
. (10.27)
Знайдемо тепер “перехресні” кінетичні коефіцієнти L eqта L qe. В ефекті Зеєбека ЕРС вимірюється при нульовому струмі (І е = 0), тому (10.24) можна переписати у вигляді
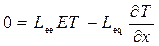 . (10.28)
. (10.28)
Інтегруючи (10.28) за довжиною системи провідників і враховуючи, що
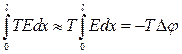 ,
,
одержимо
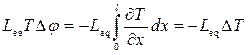 ,
,
звідки
 , (10.29)
, (10.29)
де 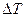 ,
, 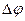 - різниця температур і різниця потенціалів між з’єднаннями провідників відповідно. Експериментально вимірний (при J е = 0) параметр
- різниця температур і різниця потенціалів між з’єднаннями провідників відповідно. Експериментально вимірний (при J е = 0) параметр 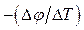 називається термоелектричною потужністю.
називається термоелектричною потужністю.
В ефекті Пельтьє два з’єднання знаходяться при однаковій температурі, в той час як через систему тече струм з густиною J e. Це спричиняє потік кількості теплоти від одного контакту до іншого. Для підтримання постійного теплового потоку (з густиною  ) треба відводити певну кількість теплоти від одного із з’єднань. Вимірний параметр
) треба відводити певну кількість теплоти від одного із з’єднань. Вимірний параметр 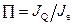 при цьому називається теплотою Пельтьє.
при цьому називається теплотою Пельтьє.
Оскільки контакти підтримуються при однаковій температурі, маємо 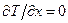 і рівняння (10.23), (10.24) набирають вигляду
і рівняння (10.23), (10.24) набирають вигляду
 , (10.30)
, (10.30)
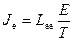 , (10.31)
, (10.31)
звідки
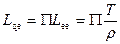 . (10.32)
. (10.32)
Використовуючи рівність 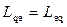 , з (10.29) та (10.32) знаходимо
, з (10.29) та (10.32) знаходимо
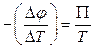 . (10.33)
. (10.33)
Експериментальні дані підтверджують співвідношення (10.33), а значить і співвідношення взаємності 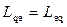 .
.
Принцип Пригожина про мінімум утворення ентропії. Як для фізики, так для хімії і біології досить важливими є стаціонарні необоротні процеси. З загальнофізичної точки зору для таких процесів повинна існувати величина, яка б набувала екстремального значення. І. Пригожин у 1947 р. сформулював принцип, згідно з яким стаціонарний слабо нерівноважний стан системи, в якій відбувається необоротний процес, характеризується мінімальним значенням швидкості виникання ентропії при даних зовнішніх умовах, які підтримують цей процес.
Встановимо правильність цього твердження на прикладі переносу енергії і переносу речовини між двома фазами з різними температурами. Тоді згідно з формулами (10.7) та (10.19) в одновимірному випадку можна записати
s = J 1 X 1 + J 2 X 2
та
J 1 = L 11 X 1 + L 12 X 2, J 2 = L 21 X 1 + L 22 X 2,
де J 1 - потік кількості теплоти, J 2 - потік речовини, X 1 і X 2 - спряжені цим потокам сили.
При заданій різниці температур (X 1 = const) стан системи з двох фаз буде стаціонарним, якщо потік J 1 є сталим (J 1 = const), а потік речовини J 2 дорівнює нулю: J 2 = L 21 X 1 + L 22 X 2 = 0. З урахуванням співвідношення взаємності L 12 = L 21 утворення ентропії в стаціонарному стані матиме вигляд
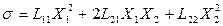 . (10.34)
. (10.34)
Одержимо з (10.34) похідну 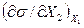 :
:
 . (10.35)
. (10.35)
Оскільки  у (10.34) є додатно означеною квадратичною функцією, одержана умова екстремуму (10.35) відповідає мінімуму утворення ентропії, що й потрібно було довести. Розглянутий випадок можна узагальнити на довільну кількість незалежних термодинамічних сил Xi.
у (10.34) є додатно означеною квадратичною функцією, одержана умова екстремуму (10.35) відповідає мінімуму утворення ентропії, що й потрібно було довести. Розглянутий випадок можна узагальнити на довільну кількість незалежних термодинамічних сил Xi.
Нелінійна термодинаміка. В станах, далеких від рівноваги, термодинамічні потоки Ji вже не є лінійними функціями термодинамічних сил Хj. В таких - нелінійних режимах багаточастинкові системи під дією внутрішніх флуктуацій або тих чи інших зовнішніх впливів можуть покидати нестійкий стан і переходити до нових станів з високоорганізованою структурою.
Загальна теорія процесів самоорганізації у відкритих сильно нерівноважних системах базується на так званому універсальному критерії еволюції Гленсдорфа-Пригожина (1954 р.). Цей критерій формулюється в термінах повного утворення ентропії Р:
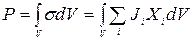 , (10.36)
, (10.36)
причому розглядається величина зміни Р з часом. Її можна записати у вигляді
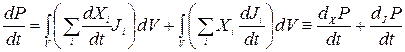 , (10.37)
, (10.37)
де 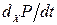 - зміни, які викликаються зміною сил Хі, а
- зміни, які викликаються зміною сил Хі, а 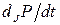 - зміни за рахунок змін потоків Ji.
- зміни за рахунок змін потоків Ji.
Можна показати, що в лінійному режимі
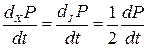 , (10.38)
, (10.38)
а якщо цей режим ще й стаціонарний, то всі похідні в (10.38) дорівнюють нулю (оскільки утворення ентропії s при цьому набуває мінімального значення).
Отже, універсальний критерій еволюції Гленсдорфа-Пригожина формулюється (за незалежних від часу граничних умовах) у вигляді нерівності
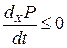 , (10.39)
, (10.39)
тобто в довільній нерівноважній системі з фіксованими граничними умовами процеси йдуть так, що швидкість зміни повного утворення ентропії за рахунок зміни термодинамічних сил зменшується. В умовах локальної рівноваги це зменшення не залежить ні від яких припущень про характер зв’язків між потоками і силами. Рівність у (10.39) відповідає стаціонарному стану.
Зазначимо, що загальна величина 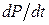 в нелінійній області не має якоїсь певної властивості.
в нелінійній області не має якоїсь певної властивості.
Покажемо правильність критерію (10.39) для процесу теплопровідності у твердому тілі з постійним об’ємом і сталим розподілом температур на його границі. З (10.37), враховуючи (10.16), знаходимо
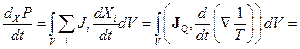
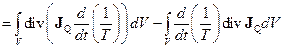 . (10.40)
. (10.40)
За теоремою Остроградського-Гаусса
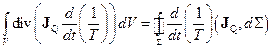 ,
,
тому цей інтеграл в (10.40) дорівнює нулю, оскільки на поверхні S (границі об’єму V) 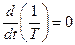 .
.
Маючи на увазі, що в (10.13) при постійному об’ємі 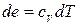 , одержуємо
, одержуємо
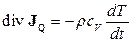 , (10.41)
, (10.41)
де 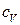 - питома теплоємність при
- питома теплоємність при 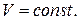 Підставляючи (10.41) у (10.40), маємо
Підставляючи (10.41) у (10.40), маємо
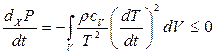 , (10.42)
, (10.42)
що й підтверджує критерій (10.39).
Дисипативні структури. Фундаментальна властивість нерівноважних систем виявляється в їх здатності переходити в стійкий упорядкований стан. При цьому втрачається однорідність систем, тобто з’являється нова симетрія, але з меншим порядком. Виникнення таких упорядкованих структур відбувається при необоротних процесах у відкритих системах вдалині від рівноваги (в нелінійній області), коли параметри систем перевищують певні критичні значення. Структури подібного роду називають дисипативними, оскільки вони підтримуються саме дисипативними процесами переносу. Існують просторові, часові та просторово-часові дисипативні структури. Розглянемо деякі з них.
Найпростішим прикладом просторових дисипативних структур є комірки Бенара (1900 р.).
Якщо горизонтальний шар рідини підігрівати знизу, між нижньою і верхньою поверхнями цього шару виникає різниця температур 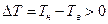 . При значеннях
. При значеннях 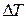 , менших за деяке характерне
, менших за деяке характерне 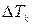 , тепло, яке підводиться знизу, розповсюджується уверх шляхом теплопровідності і рідина залишається нерухомою. Однак при
, тепло, яке підводиться знизу, розповсюджується уверх шляхом теплопровідності і рідина залишається нерухомою. Однак при 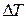 >
> 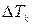 нерухома рідина вже не забезпечує перенос зростаючої кількості теплоти і в ній починається конвекція: холодна рідина опускається униз, а нагріта підіймається вгору. Розподіл цих двох протилежних за напрямком потоків виявляється самоорганізованим, оскільки в шарі виникає система правильних шестикутних комірок (мал. 1). По краях кожної такої комірки рідина опускається униз, а у центрі – підіймається вгору. Залежність повного теплового потоку
нерухома рідина вже не забезпечує перенос зростаючої кількості теплоти і в ній починається конвекція: холодна рідина опускається униз, а нагріта підіймається вгору. Розподіл цих двох протилежних за напрямком потоків виявляється самоорганізованим, оскільки в шарі виникає система правильних шестикутних комірок (мал. 1). По краях кожної такої комірки рідина опускається униз, а у центрі – підіймається вгору. Залежність повного теплового потоку 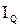 за одиницю часу (від нижньої поверхні шару до верхньої) від різниці температур
за одиницю часу (від нижньої поверхні шару до верхньої) від різниці температур 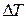 зображена на мал. 2. При
зображена на мал. 2. При 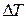 >
> 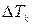 стан нерухомої рідини стає нестійким (пунктирна лінія на мал. 2) і виникає стійкий режим у вигляді конвекційних комірок Бенара.
стан нерухомої рідини стає нестійким (пунктирна лінія на мал. 2) і виникає стійкий режим у вигляді конвекційних комірок Бенара.
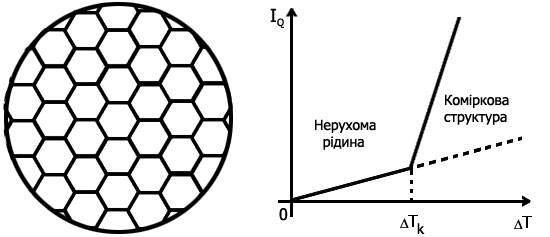
Мал. 1 Мал. 2
Отже, при переході від докритичного до надкритичного режиму, як бачимо, спонтанно змінюється симетрія системи, що аналогічно термодинамічним фазовим перетворенням. Тому такі переходи в нерівноважних системах називають кінетичними фазовими переходами.
Для опису виникання комірок Бенара використовуються нелінійні рівняння гідродинаміки. Дослідження показують, що при 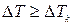 рішення цих рівнянь, яке відповідає нерухомій рідині і звичайній теплопровідності, стає нестійким, а рідина переходить у новий стійкий конвекційний режим.
рішення цих рівнянь, яке відповідає нерухомій рідині і звичайній теплопровідності, стає нестійким, а рідина переходить у новий стійкий конвекційний режим.
Іншим прикладом просторових дисипативних структур є надґратки вакансійних пор, відкриті при вивченні мікроструктури молібдену після опромінювання його іонами азоту (Дж. Еванс, 1970 р.). За певних умов такі пори, які є звичайним наслідком опромінювання, розташовуються упорядковано (втрачається їх однорідний розподіл) у вигляді правильних ґраток. Тип останніх збігається з типом кристалічних ґраток металу, а період у сотні разів перевищує період кристалічних ґраток цього металу. Виникнення такої структури спричиняється нелінійною динамічною взаємодією точкових дефектів з малими вакансійними кластерами та дифузійною взаємодією між порами.
До просторових дисипативних структур належать також кільця Сатурна. Їх виникнення зумовлене дуже нерівноважним станом речовини, що обертається навколо планети, а також взаємодією окремих частинок між собою в полі тяжіння Сатурна.
Явища самоорганізації, що призводять до упорядкованих за часом дисипативних структур, виникають при протіканні деяких нелінійних хімічних реакцій, в яких швидкість виникнення продукту реакції, наприклад, квадратично залежить від концентрацій реагуючих компонентів. У 1951 р. Б. Білоусов уперше відкрив такого роду гомогенну періодичну хімічну реакцію, в якій з періодом у 4 хв змінюється забарвлення розчину від червоного до синього і навпаки.
У ряді випадків нелінійні хімічні реакції, що протікають в тонкому шарі, призводять до виникнення просторово-часової структури, яка має вигляд кільцевих та спіральних хвиль.
У загальному випадку дисипативні структури виникають за виконанням таких чотирьох необхідних умов:
1. Система є термодинамічно відкритою, тобто може обмінюватися з навколишнім середовищем і енергією, і речовиною.
2. Динамічні рівняння системи нелінійні.
3. Відхилення від рівноваги перевищує певні критичні значення.
4. Мікроскопічні процеси проходять кооперативно (узгоджено).
На завершення зауважимо, що нестійкість і самоорганізація в дуже нерівноважних системах, які виявляються внаслідок процесів дифузії, хімічних реакцій тощо, відбуваються і на значно більш складному рівні – у живих системах. Математичне моделювання таких систем потребує використання необоротних нелінійних рівнянь, аналіз рішень яких свідчить про можливість підсилення малих флуктуацій, що саме й робить ці системи нестійкими. Часто це спричиняється автокаталітичними процесами, протікання яких переводить біологічну систему в стан з якісно новою організацією. В загальнонауковому сенсі при цьому говорять, що виконується парадигма “ порядок через флуктуації ”.






