Сучасне уявлення про механізм скорочення скелетних м’язів було запропоноване в двох роботах А.Хакслі і Х. Хакслі (1954). Фактично, це модель взаємного ковзання двох типів протофібрил. В основу моделі покладені важливі факти, одержані на основі електронномікроскопічних і рентгенографічних досліджень. Допускається, що товсті і тонкі протофібрили здатні зміщуватись відносно одна одної. Під час скорочення, загалом довжина філаментів не змінюється; відбувається тільки зміна напрямку руху (орієнтації) поперечних містків. Сила, яку розвиває саркомер в ізометричному режимі, при сталій його довжині, пропорційна кількості містків у зоні перекриття товстих і тонких протофібрил. На сьогодні існує декілька моделей і концепцій механізму скорочення скелетних м’язів.
Основними біохімічними компонентами м’язового скорочення є актин, міозин та АТФ.
Послідовність біохімічних та механічних змін на рівні саркомера представлена на рис. 13.6. Нервовий імпульс викликає вивільнення йонів Са2+ з цистерн саркоплазматичного ретикулуму:
нервове збудження
СР-Са2+ → СР + Са2+
Вільні йони Кальцію надходять до міофібрил, зв’язуються з тропоніном (Тн) тонких актинових міофіламентів, викликають конформаційні зміни молекули тропоніну, які сприяють відкриттю блокованих актинових центрів взаємодії з міозином, тобто активують актин (А) (два йони Са2+ приєднуються до однієї молекули Тн):
активація актину
Са2+ + А−Тн → А + Тн/Са2+
Йони Кальцію активують також АТФ-азу міозину (М), яка в присутності йонів Са2+ розщеплює комплекс Мg-АТФ2- до АДФ та Фн, що створює можливість сполучення актину з головками міозину:
активація міозину
М−АТФ → М * · АДФ · Фн
утворення комплексу
М* · АДФ · Фн + А → А · М * · АДФ · Фн
Процес приєднання актину до головок міозину супроводжується відʼєднанням продуктів продуктів АТФ-азної реакції і вивільненням хімічної енергії, яка перетворюється в механічну енергію напруження актоміозинових комплексів руху тонких ниток до центра саркомера:
розвиток напруження
А · М* · АДФ · Фн → А · М · АДФ + Фн + ∆Q
При ковзанні тонких ниток вздовж товстих ступінь напруження знижується і головки міозинових молекул легко з’єднуються з вільними молекулами АТФ, що призводить до розриву актоміозинового комплексу:
розрив комплексу
А · М + АТФ → А + М · АТФ
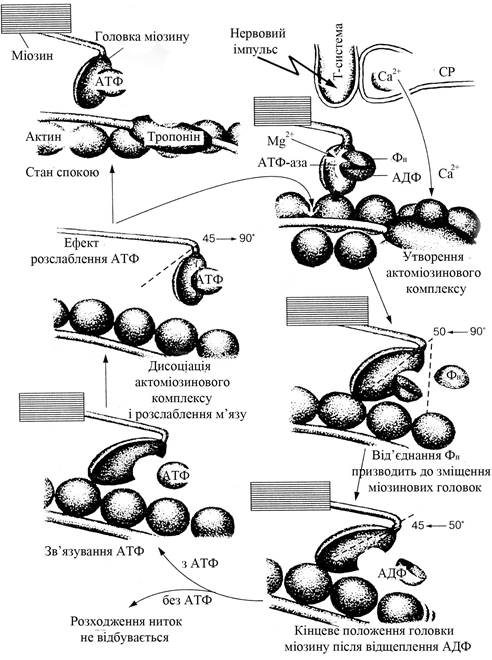
Рис. 13.6. Біохімічний механізм скорочення і розслаблення мʼязу
Якщо збудження м’яза не припиняється, то цикл вищеописаних реакцій повторюється, але вже з сусіднім активним центром тонкої нитки. При завершенні нервової стимуляції м’язу ацетилхолін швидко розщеплюється ацетилхолінестеразою − встановлюється вихідний поляризований стан сарколеми. Вільні йони Са2+ з саркоплазми поглинаються назад саркоплазматичним ретикуломом за допомогою АТФ-залежної Са2+-помпи (Са2+АТФ-аза), що розщеплює АТФ із виділенням енергії, яка використовується для закачування Са2+ до цистерн ендоплазматичної сітки. При гідролізі однієї молекули АТФ переносяться два йони Са2+:
розслаблення
Т−Са2+ + АТФ + СР → Т + СР−Са2+ + АДФ + Фн
Видалення йонів Са2+ від скоротливих білків приводить до початку розслаблення. У стані спокою концентрація йонів Са2+ у саркоплазматичному матриксі дуже низька (10-8 моль/л) і дуже висока (10-5 моль/л) в цистернах саркоплазматичнох сітки. Це призводить до втрати активності АТФ-ази міозину. Головки міозинових ниток зв’язують, але не розщеплюють АТФ. Тропонін за відсутності кальцію знову блокує активні центри тонких ниток. Актоміозинові комплекси розриваються, актинові і міозинові нитки розходяться. Під дією білків строми м’яз повертається у вихідне положення, відновлює попередні запаси АТФ і КрФ.






