Львівський університет
Найважливішим механізмом токсичної дії СО є лігандування з гемопротеїдами, і, в першу чергу, з гемоглобіном. Взаємодія оксиду вуглецю з гемоглобіном крові призводить до утворення карбоксигемоглобіну (СО-Нв), наслідком цього є зниження киснезв`язуючої здатності крові, причиною високої конкурентно здатності оксиду вуглецю відносно кисню є його висока спорідненість до дезоксигемоглобіну, яка перевищує в 250 – 300 разів спорідненість до даного дихального білка кисню [3, 5, 6]. Таким чином при підвищеній концентрації оксиду вуглецю в середовищі утворюється патологічний комплекс СО-Нв, що веде до немічного типу кисневої недостатності. Надходження кисню до клітин тканин при цьому значно знижується.
В останнє десятиліття багатьма дослідженнями встановлено, що одним із джерел оксиду вуглецю є повітря, яке людина видихає. Цей, ендогенного походження оксид вуглецю, утворюється при метаболізмі гемвмісних білків. У випадку перебування людини в герметизованих приміщеннях накопичується оксид вуглецю, який стає причиною аутоинтоксикації.[5].
Діагностика, лікування і профілактика отруєнь чадним газом потребують розробки експресивних і надійних методів визначення СО-Нв у крові людини. Одним із перспективних методів є метод спектрофотометричного аналізу комплексу СО-Нв [7]. Цей методичний підхід найбільш підходить для широкого використання, особливо в двохвилевому варіанті аналізу бінарних сумішей гемоглобінів. В цих випадках найчастіше використовують дитионітний метод аналізу карб оксигемоглобіну в різних модифікаціях [3]. Теоретично доведено, що для аналізу двокомпонентних систем достатньо вибрати дві довжини хвилі, одну із яких зручно брати в ізобестичній точці [8].
В наших дослідженнях в якості вихідного матеріалу визначення карб оксигемоглобіну бів обраний дитіонітний метод з використанням двох довжин хвиль – 538 і 550 нм [4].
Ціллю даної роботи було теоретичне обґрунтування і методичне здійснення оптимізації способу визначення карбоксигемоглобіну в цільній крові людей. В результаті вибрані оптимальні параметри процесу гемолізу еритроцитів крові і реакції відновлення гемоглобіну, які дозволяють підвищити простоту, експресивність і точність виконання аналізу на автоматичному фотометрі, створеному для цієї цілі.
МАТЕРІАЛИ І МЕТОДИ
Дослідження проводили на очищення гемоглобіну, відмитих від плазми еритроцитах і цільної крові. Гемоглобін із еритроцитів крові людини отримували по методу Драбкина [9]. Концентрацію гемоглобіну визначали в ціанометформі [7].
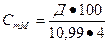 , де
, де
Д – оптична густина розчину гемоглобіну при 540 нм; 100 – розведення, 10,99 - мілімолярний коефіцієнт екстинції (в розрахунку на 1 гем), ціанметгемоглобіну при 540 нм [7]; 4 - коефіцієнт перерахунку від 1 гема на тетраметр.
Спектрофотометричні виміри проводили на приборах СФ-26 і "Спекорд" (ГДР).
Оксигемоглобін; до 0,1 мл 1 мМ розчину гемоглобіну, додатково оксигенованого чистим О2 і перевіреного на відсутність метформии по Родки і О`Нилу [10], додавали 4,9 мл відповідного буферу і проводили спектрофотометрування протии буфера.
Отриманий розчин гемоглобіну слугував також вихідним для приготування дезокси- і карбоксиформ.
Дезоксигемоглобін отримували додаванням до 5 мл розчину НвО2 3-5 мг сухого дитіоніту натрія. Через 2-3 хвилини проводили спектрофотометри чні виміри.
Карбоксигемоглобін готували пропускаючи СО через розчин оксигемоглобіну протягом 15-20 хв.
Калібрувальні досліди. Для визначення кількісного вмісту карбоксигемоглобіну в суміші з дезоксигемоглобіном будували калібрувальні графіки. В якості вихідних розчинів використовували 10 мкМ-ні оксигемоглобін і карбоксигемоглобін в 0,1 М фосфатному буфері, рН 7,3. Модельні суміші з вмістом СО-Нв від 10 до 100% отримували з допомогою двох послідовно розміщених по ходу променя 1 см-кювет, помістивши в кожну відповідну форму гемоглобіну при концентраціях, вказаних в табл. 1.
В проби з 5 мл оксигемоглобіну безпосередньо перед спектрофотометруванням вносили 8 мг відновлюючої суміші А (див. нижче) для отримання дезоксиформи (оптичну густину «сумішей» вимірювали при 538 і 550 нм через 2-3 хв після додавання відновлювача проти води, яка також внесена у дві кювети.
Таблиця 1
Дані калібрувальних дослідів визначення СО-Нв в «суміші» з нВ (спектрофотометр СФ-26)
| № п/п | % СО-Нв | СО-Нв (с=10 мкМ) мл | 3 мМ фосфатний буфер, рН 7,36 мл | Нв (с=10 мкМ) мл | 3 мМ фосфатний буфер, рН 7,36 мл | % Нв | Д538 | Д550 | Д538/Д550 |
| 4,5 | 0,5 | 0,5 | 4,5 | 0,536 | 0,461 | 1,16 | |||
| 4,0 | 1,0 | 1,0 | 4,0 | 0,520 | 0,462 | 1,12 | |||
| 3,5 | 1,5 | 1,5 | 3,5 | 0,502 | 0,462 | 1,09 | |||
| 3,0 | 2,0 | 2,0 | 3,0 | 0,497 | 0,481 | 1,01 | |||
| 2,5 | 2,5 | 2,5 | 2,5 | 0,476 | 0,485 | 0,98 | |||
| 2,0 | 3,0 | 3,0 | 2,0 | 0,472 | 0,485 | 0,96 | |||
| 1,5 | 3,5 | 3,5 | 1,5 | 0,450 | 0,485 | 0,92 | |||
| 1,0 | 4,0 | 4,0 | 1,0 | 0,436 | 0,502 | 0,87 | |||
| 0,5 | 4,5 | 4,5 | 0,5 | 0,425 | 0,508 | 0,84 | |||
| 5,0 | 5,0 | 0,415 | 0,517 | 0,80 |
Калібрувальні досліди повторювали три рази. По середніх значеннях оптичних густин визначали відношення Д538/Д550 і будували калібрувальний графік залежності цього параметра від відсоткового вмісту СО-Нв (табл. 1, рис. 1). На основі параметрів отриманої калібрувальної прямої виведена аналітична формула для розрахунку відсоткового вмісту СО-Нв в суміші.
 (1)
(1)
Кінетику гемолізу еритроцитів крові розчинами різного складу досліджували наступним чином. До 3 мл розчину, який досліджували на гемолітичну активність (в кюветі) додавали 20 мкл еритромаси. Суміш швидко перемішували і через 30 с знімали залежність густини розчину при 630 нм від часу, на СФ-26, якмй оснащений самописцем Н-39. Контролем слугувала вода.
Визначення вмісту карбоксигемоглобіну в цільній крові людей. Для аналізів використовували периферичну кров (20-30 мкл), взяту із пальця за допомогою скляного капіляра попередньо промитого розчином гепарину (50000 од/мл). для відновлення гемоглобіну використовували сухі суміші дитіоніту натрію з компонентами а, К-фосфатного або боратного буферу. Розрахунок кількості компонентів проводився з урахуванням кінцевої концентрації буферу 3-5мм і рН 7,36 (для фосфатного) і рН 9,18 (для боратного) і вмісту дитіоніту на 1 пробу об`ємом 3 мл - 4 мг.
Склад сумішей
Суміш А: а2НРО4 ▪ 12Н2О – 0,2602 г; КН2РО4 – 0,0236 г; а2 2О4 – 0,4000 г.
Суміш Б: а2В4О7 ▪ 10Н2О – 0,3432 г; а2 2О4 – 0,4000 г.
Для дозування кількості внесеної відновлюючої суміші використовували ложечку – дозатор, яка відбирає -8 ± 1 мг суміші А і 11 ± 1,5 мг – для суміші Б.
У 1 см кювету з 3 мл Н2О вносили 20-30 мкл гепаринізованої крові, закривали кришкою, вміст перемішували. Через 1-2 хв до розчину додавали відновлюючу суміш, перемішували. Оптичну густину розчину вимірювали на спектрофотометрі СФ-26 при 536 і 550 нм. Розрахунок СО-Нв проводили за формулою (1).
У серійних визначеннях використовували набір пробірок, які містили по 3 мл води, в які вносили по 20-30 мкл гепаринізованої свіжої крові. Суміш перемішували. Після закінчення серій взяття крові у кількох людей в кожну пробу безпосередньо перед спектрофотометруванням вносили відновну суміш і через 1 хв проводили вимірювання.
РЕЗУЛЬТАТИ ДОСЛІДЖЕНЬ І ЇХ ОБГОВОРЕННЯ
У зв'язку з тим, що в якості початкового способу визначення карбоксигемоглобіну нами застосований дитіонітний метод [4], було проведено дослідження оптимальних параметрів реакції відновлення HвO2 до Нв. На підставі порівняльних спектрофотометричних досліджень встановлено, що повне переведення НвО2 в Нв і сталість спектральних характеристик останнього спостерігається в широкому діапазоні молярності (3,3 - 100 мМ) і рН (6,0 - 9,18) двох досліджуваних буферів - фосфатного і боратного Для повного відновлення 5 мл 20 мкМ гемоглобіну потрібно З-5 мг дитіоніту натрію. Карбиксигемоглобін в діапазоні вказаних параметрів системи також зберігає сталість своїх спектральних властивостей.
Одним з важливих умов виконання аналізу лігандних форм гемоглобіну в цільній крові є забезпечення повного гемолізу еритроцитів. У зв'язку з цим була досліджена гемолізуюча здатність води, деяких буферів, а також детергентів – сапонінів і тритон Х-100. На рис. 2 представлена кінетика гемолізу еритроцитів людини водою, 3,3 мМ фосфатним буфером і різними концентраціями сапоніну (від 0,01 до 0,16 мг/мл). Виявилося, що вода гемолізує еритроцити приблизно за 4-5 хв, 3 мМ фосфатний буфер, рН 7,36 руйнує еритроцити приблизно через 1 хв, причому оптична густина отриманого гемолізату при 630 нм істотно нижча, ніж для водного гемолізату, що свідчить про кращу розчинності строми в буфері, ніж просто в Н2О. Гемолізуюча здатність сапоніну з підвищенням концентрації збільшується від 5 хв при С = 0,01 мг/мл до приблизно 0,5 хв при С = 0,16 мг/мл. Однак застосування сапоніну з концентрацією більше 0,06 мг/мл призводить до збільшення поглинання при 630 нм, що пов'язано, мабуть, з помітним помутнінням розчину. Причина цього явища не зрозуміла. Можливо, при більших концентраціях сапоніну спостерігається денатурація білка, як це відмічено для впливу додецилсульфату натрію на гемоглобін [1].
На рис.3 показано кінетику гемолізу еритроцитів фосфатним і боратним буферами (рН 7,36 і 9,18 відповідно) з різною молярністю - 3,3-100 мМ. Фосфатний буфер стабілізує еритроцити починаючи з концентрації 0,1 М, а боратний - з 2 мМ. Оптимальними концентраціями для забезпечення гемолізу є 3-10 мМ для фосфатного і 3-5 мМ для боратного буферу, причому швидкість гемолізу в таких умовах вища, ніж в H2O. Крім того остаточна оптична густина гемолізату в таких буферах нижча, ніж в H2О, що пов'язано, судячи з усього, з кращою строморозчиняючою здатністю буферів, ніж води.
На рис.4 представлені результати вивчення гемолізуючої здатності водних розчинів тритон Х-100 при різних концентраціях цього детергенту. Показано, що детергент гемолізує еритроцити дуже швидко (1 хв) в діапазоні концентрацій: 0,1-1,0%, забезпечуючи при цьому велику стромо розчинну здатність, ніж вода. Встановлено також, що присутність тритон Х-100 у встановлених концентраціях не впливає на спектральні характеристики дезоксигемоглобіну. Таким чином, з точки зору забезпечення повного і швидкого гемолізу еритроцитів і кращого розчинення компонентів строми найбільш оптимальними виявились фосфатний і боратний буфери (рН 7,36і і 9,18) з молярністю 3-5 мМ, а також тритон Х-100 при концентрації 0,1-1,0%. Для подальших аналізів СО-Нв в цільній крові нами використані відновлювальні суміші на основі двох буферів – фосфатного і боратного, які дають практично однакові результати (див. таблицю 2). Були проведені одиничні і серійні визначення карбоксигемоглобіну в цільній крові людей (див. розділ "матеріали і методи»).
Ці два підходи дають аналогічні результати. Серійний варіант проведення аналізів має ту перевагу, що одночасно можна взяти кров на дослідження у багатьох людей і створюються оптимальні умови гемолізу еритроцитів.
Таблиця 2
Вміст карбоксигемоглобіну в цільній крові людей
| № п/п | суб | Боратний буфер | Фосфатний буфер | Загальне середнє % СО-Нв | ||
| % СО-Нв | % СО-Нв | |||||
| М+ | М+ | |||||
| А | 1,03 ± 0,55 | 1,30 ± 0,55 | ||||
| Б | 3,38 ± 0,82 | 2,45 ± 0,79 | 2,91 ± 0,47 | |||
| В | 2,98 ± 0 | 2,98 ± 0 | ||||
| Г | 6,27 ± 0,90 | 5,35 ± 2,58 | 5,81 ± 0,46 | |||
| Д | 4,02 ± 0,35 | 3,13 ± 0,38 | 3,57 ± 0,44 | |||
| Е | 3,75 ± 0,67 | 3,91 ± 0,09 | 3,83 ± 0,08 | |||
| Ж | 5,91 ± 0,65 | 7,23 ± 0,71 | 6,57 ± 0,66 | |||
| З | 2,69 ± 1,37 | 2,69 ± 1,37 | ||||
| И | 1,03 ± 0,49 | 0,80 ± 0 | 0,91 ± 0,11 |
Точність аналізу карбоксигемоглобіну залежить у великій мірі і від похибки шкали використовуваного спектрофотометра (СФ-26). Так, похибки при вимірах оптичної густини на 0,010-0,005 одиниць призводять до похибки у визначенні вмісту СО-Нв - на 3%.
Слід зазначити, що дуже важливим елементом, що забезпечує точність результатів, є недопущення утворення фібрину, яке веде до появи каламуті в розчині. Для цієї мети капіляр для забору крові повинен бути попередньо промитий гепарином. Крім того, не рекомендується брати більше трьох проб крові з одного проколу пальця оскільки в протилежному випадку ймовірність утворення фібрину підвищується. Для більшої надійності визначення рекомендується проводити два-три паралельних аналізи. Зазначені складності не зустрічаються при аналізі СО-Нв в гепаринізованій крові, взятої з вени.
З метою практичного застосування оптимізованої нами методики було проведено аналіз карбоксигемоглобіну в цільній крові здорових людей (табл. 2). Позначилося, що вміст СО-Нв в крові коливається в межах 0,9-6,6%. Із літератури відомо, що у здорових некурящих людей карбоксигемоглобін виявляється в кількостях від 0,25 до 2,1% загального гемоглобіну. У курящих ці величини можуть зростати до 6,6% [3]. Забруднення повітря в міській місцевості підвищує вміст СО-Нв в крові до 2-4%, причому у курців до 2-4%, а в деяких випадках і до 16% [8].
Таким чином, отримані нами результати з урахуванням помилки визначення знаходяться у відповідності з літературними даними. Відповідно, модифікація відомого способу визначення С0-Нв [4], який полягає у спрощенні процедури аналізу – застосування в якості реактивів тільки води і сухого реагенту, який поєднує функції буферної системи і відновника і не перешкоджає гемолізу еритроцитів, дозволяє добитися достатньої точності і відтворюваності результатів аналізу при кращій його пристосованості для виконання на автоматичному фотометрі.
ЛІТЕРАТУРА
1. Артюхов В.Г., Шмельов В.П. Український біохімічний журнал. 1977 т.49,»2, с.12-15
2. Доіс видання. Кількісні проблеми біохімії. М:. Світ, 1983.
3. Кушаковський М.С. Клінічні форми пошкодження гемоглобіну.- Л. Медицина 1968 року.
4. Методичні вказівки про кількісний визначенні карбоксігемо глобіну і карбоксимиоглобина. М:. МОЗ СРСР, 1974.
5. Сксенгендлер Г.І. Отрути і протівоядія.Л. Наука, 1982.
6. Тиунов Л.А., Кустов В.В. Токсикологія окису вуглецю. М:. Міді цина, 1980.






