1.Определить рН буферного раствора, состоящего из 20мл уксусной кислоты СН3СООН (С=0,03 моль/л) и 15 мл ацетата натрия СН3СООNa (С=0,06 моль/л).
рКа (СН3СООН)=4,74.
Образец решения: Для практических расчетов рН уравнение Гендерсона-Гассельбаха удобно записать в следующей форме:

Подставив в уравнение исходные данные, получим рН буферной системы.
 .
.
2.Рассчитать рН ацетатного буферного раствора приготовленного из 80 мл раствора СН3СООН (С=0,1 моль/л) и 20 мл раствора СН3СООNa (С=0,1 моль/л). рКа (СН3СООН)=4,74.
Ответ: рН=4,14
3.Вычислить рН ацетатной буферной системы, приготовленной из 0,1 моль СН3СООН и 1 моль СН3СООNa, рКа (СН3СООН)=4,74. По отношению к кислым или щелочным продуктам эта буферная система обладает большей буферной емкостью?
Ответ: рН=5,74
Вк >Вщ
4.Найти рН смеси из 5 мл водного раствора аммиака NH3·H2O (C=0,1 моль/л) и 9 мл хлорида аммония NH4Cl (С=0,1 моль /л). рКв (NH3·H2O)=4,74
Ответ: рН=9
5. Каков рН буферной смеси, имеющий одинаковые концентрации по NH3·H2O и NH4Cl. рКв (NH3·H2O)=4,74
Ответ: рН=9,26
6. Вычислить соотношение концентраций уксусной кислоты СН3СООН и ацетата натрия СН3СООNa в буферном растворе, чтобы рН равнялся 5,74.
рКа (СН3СООН)=4,74.
Ответ: Сс/Ск=10.
7.Вычислить рКа молочной кислоты, если рН раствора, в 1 л которого содержится 0,01 моль молочной кислоты СН3СНОНСООН и 0,0139 моль лактат-иона СН3СНОНСОО-, равен 4,0.
Ответ: рКа (СН3СНОНСООН)=3,86
8.Как изменится величина рН буферного раствора (из задачи 1), если к нему добавить 5 мл раствора HCl (С=0,1 моль/л).
Образец решения: Значение рН раствора до добавления соляной кислоты берем из решения задачи 1 (рН0=4,92)
Находим рН буферного раствора после добавления кислоты.При этом учитываем, что количество СН3СООН увеличилось, а соли уменьшилось, эквивалентно добавленной HCl.



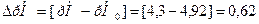
9. Как изменится величина рН буферного раствора, состоящего из 30 мл водного раствора аммиака NH3·H2O (С=0,2 моль/л) и 15 мл раствора NH4Cl (С=0,1моль/л), при добавлении 5мл раствора НCl (C=0,1 моль/л), рКв (NH3·H2O)=4,74
Ответ: 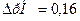
10. Рассчитайте ёмкость буферного раствора по кислоте, если при добавлении к 50мл этого раствора 2мл HCl  рН изменился от 7,3 до 7,0.
рН изменился от 7,3 до 7,0.
Образец решения: Используем формулу:

11. К 100 мл крови для изменения рН от 7,36 до 7,0 надо добавить 3,6 мл HCl  . Какова буферная ёмкость крови?
. Какова буферная ёмкость крови?
Ответ: Вк=0,005 моль/л
12. Рассчитайте ёмкость буферного раствора по кислоте, если к 100 мл этого раствора добавили 50 мл HCl  , рН при этом изменился на 0,18.
, рН при этом изменился на 0,18.
Ответ: Вк=0,027 моль/л
Вопросы для самоконтроля
1. Какие из приведенных смесей являются буферными растворами: HCl+NaCl; СН3СООН+ СН3СООNa; NH3·H2O+ NH4Cl; NaOH+NaCl; НСООН+НСООК?
2. Обладает ли раствор слабой кислоты буферным действием?
3. Обладает ли буферным действием раствор аминокислоты?
4. Почему для приготовления буферного раствора используют слабые кислоты или основания, а не сильные?
5. Почему в буферных системах организма акцепторов Н+ больше, чем доноров Н+ ?
6. Какая кислотность практически остается без изменения при добавлении к буферному раствору небольшого количества щелочи?
7. Какая кислотность изменяется при добавлении к буферному раствору небольшого количества NaOH?
8. Какое влияние оказывает разбавление на величину рН буферного раствора?
9. Какое влияние оказывает разбавление на величину буферной емкости системы?
10. При каких условиях и при каком значении рН наблюдается максимальная буферная емкость системы?
11. Какая из двух кислотных буферных систем:
а) рН= рКа +1
б) рН= рКа -1
обладает большей буферной емкостью по отношению к избытку кислых и какая к избытку основных эквивалентов?
12. Какая из основных буферных систем:
а) рОН= рКв +1
б) рОН= рКв -1
обладает большей буферной ёмкостью по отношению к избытку кислых и какая к избытку основных эквивалентов?
13. Какой из буферных растворов:
а) ацетатный (рКа (СН3СООН)=4,74)
б) фосфатный (рКа  )
)
при рН 5,5 обладает большей устойчивостью к избытку кислых или основных эквивалентов?
14. Какую из кислот:
а) рКа (СН3СООН)=4,74)
б) рКа (Н2СО3)=6,36
в) рКа 
лучше всего использовать для приготовления буферного раствора с наибольшей буферной емкостью при рН 7,4?
15. Если рН буферного раствора больше рКа кислоты буфера, что нужно добавить в систему, чтобы рН= рКа?
16. В замкнутых помещениях часто испытывают удушье, связанное с избытком СО2. Какое патологическое явление возникает в крови?
17. При подъеме в горы наблюдается гипервентиляция легких. Какое нарушение кислотно-основного гомеостаза при этом возможно?
18. Как влияет изменение парциального давления СО2 на КОС организма?
19. У больного рН крови 7,18, щелочные резервы снижены. Какой вид нарушения КОС наблюдается?
20. Какое патологическое явление связано с увеличением кислотной буферной емкости?






