| № | Тип системы | Название системы | Состав системы | Состав раствора | Область действия, DрН |
Кислотные 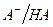
| Ацетатная | 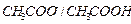
| 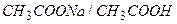
| 3,8–5,8 | |
| Гидрокарбонатная | 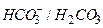
| 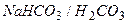
| 5,4–7,4 | ||
| Фосфатная | 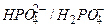
| 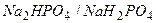
| 6,2–8,2 | ||
Основные 
| Аммиачная | 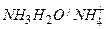
| 
| 8,2–10,2 | |
| Амфолиты (содержат кислотную и основную группы) | Белковая и аминокислотная | 
|  Соль белка-кислоты Белок-кислота
Соль белка-кислоты Белок-кислота
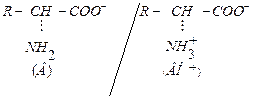 Белок-основание Соль белка-основания
Белок-основание Соль белка-основания
| pH<6,0 pH>6,0 |
Механизм защитного действия буферных систем по поддержанию постоянства рН среды сводится к связыванию добавляемых в раствор ионов 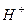 и
и 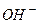 компонентами буферной системы в малодиссоциирующие соединения.
компонентами буферной системы в малодиссоциирующие соединения.
1. Механизм буферного действия кислотных буферных систем на примере ацетатного буфера 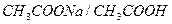
Ацетатная буферная система состоит из слабой кислоты  (донор
(донор 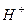 ) и сопряженного основания
) и сопряженного основания 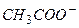 (акцептор
(акцептор 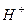 ), в растворе
), в растворе 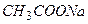
При добавлении к буферному раствору сильной кислоты ионы 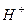 связываются ацетат-ионами в слабую уксусную кислоту:
связываются ацетат-ионами в слабую уксусную кислоту:
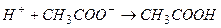 ,
,
а при добавлении щелочей ионы 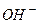 нейтрализует уксусная кислота, связывая их в молекулы воды:
нейтрализует уксусная кислота, связывая их в молекулы воды:
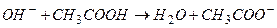
Концентрации компонентов буферной системы и их отношение меняются незначительно, поэтому рН раствора остается практически постоянным.
2. Механизм буферного действия основных буферных систем на примере аммиачного буфера 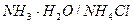 .
. 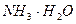 - слабое основание (акцептор
- слабое основание (акцептор 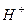 ),
), 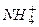 - сопряженная кислота (донор
- сопряженная кислота (донор  ), в растворе
), в растворе  .
.
Нейтрализация кислот:
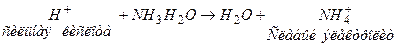
Нейтрализация щелочей:
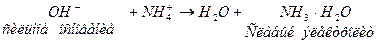
Каждая буферная система характеризуется определенной концентрацией ионов водорода (рН), которую стремится сохранить при добавлении кислоты, основания или при разбавлении. Определяется рН буферных растворов по уравнению Гендерсона-Гассельбаха.
В основе расчета рН буферных систем лежит закон действующих масс для кислотно-основного равновесия.
1. Вывод уравнения Гендерсона-Гассельбаха для кислотных буферных систем на примере ацетатного буферного раствора 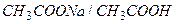 .
.
В кислотных буферных системах всегда наблюдаются два процесса:
обратимый – диссоциация слабой кислоты:

необратимый – диссоциация соли:

Концентрация ионов 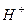 легко вычислить из константы кислотно-основного равновесия уксусной кислоты (константы диссоциации):
легко вычислить из константы кислотно-основного равновесия уксусной кислоты (константы диссоциации):

Откуда:

Присутствие в буферном растворе сильного электролита с одноименным анионом подавляет и без того слабую диссоциацию уксусной кислоты 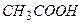 (принцип Ле Шателье). Поэтому концентрация недиссоциированных молекул
(принцип Ле Шателье). Поэтому концентрация недиссоциированных молекул 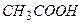 практически равна равновесной концентрации кислоты, а концентрация ионов
практически равна равновесной концентрации кислоты, а концентрация ионов  - концентрации соли.
- концентрации соли.
В данном случае:
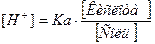
Прологарифмировав выражение, получаем уравнение Гендерсона-Гассельбаха для кислотных буферных систем:

2. Вывод уравнения Гендерсона-Гассельбаха для основных буферных систем на примере аммиачного буферного раствора NH3.H2O/NH4Cl
При взаимодействии слабого основания с водой последняя, выступая донором H+, способствует ионизации этого основания:

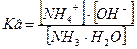
Отсюда: [OH−]= 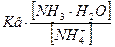
Или [OH−]= 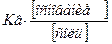
Прологарифмировав, получаем:
рОН= 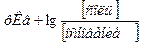
рН= 
Из уравнения Гендерсона-Гассельбаха следует ряд важных выводов.
1. рН буферных растворов зависит от отрицательного десятичного логарифма константы диссоциации слабой кислоты рКа или основания рКв и от отношения концентраций кислотно-основной пары, но практически не зависит от разбавления раствора.
2. Значения рКа любой кислоты и рКв любого основания можно вычислить по измеренному рН раствора, если известны молярные концентрации компонентов.
3. Уравнение Гендерсона-Гассельбаха позволяет рассчитать рН буферного раствора, если известны значения рКа (рКв) и молярные концентрации компонентов.
4. Уравнение Гендерсона-Гассельбаха можно использовать для определения отношения компонентов буфера, чтобы приготовить раствор с заданным значением рН.
Способность буферных растворов сохранять рН ограничена. Прибавлять кислоту и щелочь, существенно не меняя рН буферного раствора, можно лишь в небольших количествах.
Величина, характеризующая способность буферного раствора противодействовать смещению реакции среды при добавлении кислот и щелочей, называется буферной емкостью.
Буферная емкость (В) измеряется количеством моль или ммоль эквивалента кислоты или щелочи, добавление которого к 1 л буферного раствора изменяет рН на единицу.
Различают буферную емкость по кислоте (Вк) и буферную емкость по основанию (Вщ), которые рассчитываются с помощью уравнений:
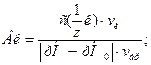
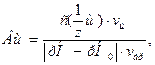
где 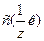 и
и  - молярные концентрации эквивалента кислоты или щелочи соответственно, моль/л (моль/л);
- молярные концентрации эквивалента кислоты или щелочи соответственно, моль/л (моль/л);
vк и vщ - объемы добавленных кислоты или щелочи, л;
vбр - объем буферного раствора, л;
│рН-рНо│- разность рН буферного раствора по модулю.
Буферная емкость зависит от ряда факторов.
1. Чем выше концентрации компонентов буферного раствора, тем больше его буферная емкость.
2. Буферная емкость зависит от отношения концентраций компонентов, а следовательно, и от рН буфера. При рН=рКа буферная емкость максимальна.
3. Установлено, что достаточное буферное действие наблюдается, если концентрация одного из компонентов превышает концентрацию другого не более, чем в 10 раз.
Интервал рН=рКа±1 называется зоной буферного действия.
4. При разбавлении буферного раствора величина буферной емкости уменьшается вследствие снижения концентрации компонентов раствора.
Буферные системы организма – это, прежде всего, гидрокарбонатная, гемоглобиновая, фосфатная и белковая. Все эти системы имеются в крови, где с их помощью особенно строго поддерживается рН=7,4±0,05, несмотря на поступление в кровь из кишечника и тканей значительного количества кислот и небольшого- оснований.
Гидрокарбонатная буферная система 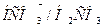 состоит из угольной кислоты
состоит из угольной кислоты 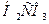 (донор протона) и сопряженного основания
(донор протона) и сопряженного основания  (акцептор протона) в растворе
(акцептор протона) в растворе 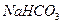 .
.
Ее особенность в том, что один из компонентов- угольная кислота 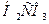 образуется при взаимодействии растворенного в плазме СО2 с водой. Между СО2 в альвеолах и гидрокарбонатным буфером в плазме крови, протекающей через капилляры легких, устанавливается цепочка равновесий:
образуется при взаимодействии растворенного в плазме СО2 с водой. Между СО2 в альвеолах и гидрокарбонатным буфером в плазме крови, протекающей через капилляры легких, устанавливается цепочка равновесий:
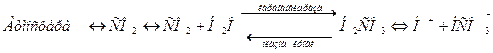
Угольная кислота при физиологическом значении рН=7,4 находится преимущественно в виде  , а отношение компонентов буферной системы крови
, а отношение компонентов буферной системы крови 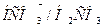 = 20:1. Таким образом, главное назначение гидрокарбонатного буфера заключается в нейтрализации кислот:
= 20:1. Таким образом, главное назначение гидрокарбонатного буфера заключается в нейтрализации кислот:
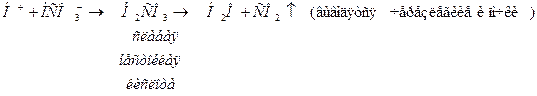
Нейтрализация оснований:
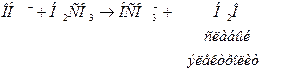
Гидрокарбонатная буферная система является системой быстрого эффективного реагирования, т.к. продукт ее взаимодействия с кислотами- углекислый газ- быстро выводится через легкие. Нарушение кислотно- основного равновесия в организме компенсируется прежде всего гидрокарбонатным буфером (за 10–15 минут).
Гидрокарбонатный буфер обеспечивает около 55% от всей буферной емкости крови. Он содержится также в эритроцитах, межклеточной жидкости и в почечной ткани.
Уравнение Гендерсона-Гассельбаха для гидрокарбонатного буфера имеет вид:
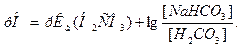
Согласно цепочке равновесий содержание Н2СО3 определяется концентрацией растворенного СО2 , которая по закону Генри пропорциональна давлению СО2 в газовой фазе. В конечном счете оказывается, что [H2CO3] пропорциональна р(СО2 ) и уравнение Гендерсона-Гассельбаха с учетом этого принимает вид:
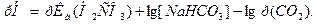
Фосфатная буферная система  содержится в крови и клеточной жидкости других тканей, особенно почек. В клетках она представлена
содержится в крови и клеточной жидкости других тканей, особенно почек. В клетках она представлена  и
и 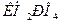 , а в плазме крови и межклеточной жидкости
, а в плазме крови и межклеточной жидкости 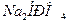 и
и 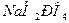 . Роль донора протона в этой системе играет ион
. Роль донора протона в этой системе играет ион  , а акцептора протона – ион
, а акцептора протона – ион  . Из уравнения Гендерсона-Гассельбаха для фосфатной буферной системы
. Из уравнения Гендерсона-Гассельбаха для фосфатной буферной системы
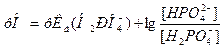
следует, что при значении рНкрови=7,4 отношение 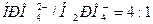 . Следовательно, и эта система имеет буферную емкость по кислоте больше, чем по основанию. При накоплении катионов Н+ во внутриклеточной жидкости, например, после приема мясной пищи происходит их нейтрализация ионами
. Следовательно, и эта система имеет буферную емкость по кислоте больше, чем по основанию. При накоплении катионов Н+ во внутриклеточной жидкости, например, после приема мясной пищи происходит их нейтрализация ионами  :
:
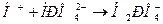 (выводится почками, моча кислая, рН≈4,8)
(выводится почками, моча кислая, рН≈4,8)
При увеличении концентрации оснований в организме, например при употреблении растительной пищи, они нейтрализуются ионами 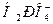 :
:
 (удаляется почками, моча щелочная, рН≈7,5)
(удаляется почками, моча щелочная, рН≈7,5)
Фосфатная буферная система более «консервативна», чем гидрокарбонатная, т.к. фосфатная система работает преимущественно с почками, а гидрокарбонатная с легкими. Длительность восстановления отношения 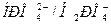 до нормы составляет 2-3 суток, а для
до нормы составляет 2-3 суток, а для 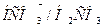 - 10-18 часов. Этот факт необходимо учитывать при терапевтической коррекции нарушений кислотно-основного равновесия организма.
- 10-18 часов. Этот факт необходимо учитывать при терапевтической коррекции нарушений кислотно-основного равновесия организма.
Белковые буферные системы бывают анионного (основного) и катионного (кислотного) типов, в зависимости от кислотно-основных свойств белка, которые характеризуются его изоэлектрической точкой (рI). Изоэлектрические точки большинства белков плазмы крови лежат в слабокислой среде (рI=4,9-6,3). При рН>рI эти белки существуют в анионной форме, а при рН<рI - катионной.
Анионный белковый буфер работает в крови (рН>6). Он состоит из белка-основания (анионная форма белка ― акцептор Н+) и сопряженной кислоты (диполярный ион ― донор Н+):

белок-основание (В) белок-соль ― сопряженная кислота( )
)
Механизм действия:
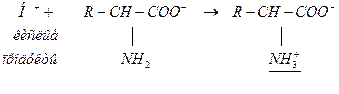
| слабый электролит | |
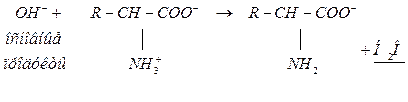
| слабый электролит | |
Катионная белковая буферная система обычно поддерживает величину рН в физиологических средах с рН<6. Она состоит из белка-кислоты (катион белка-донор Н+) и сопряженного основания (диполярный ион ― акцептор Н+):

белок-кислота(НА) белок-соль ― сопряженное основание ( )
)
Механизм действия:

| слабый электролит |
слабый электролит
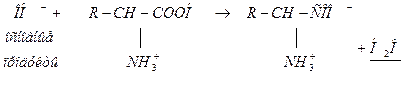 слабый электролит
слабый электролит
Гемоглобиновая 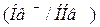 и оксигемоглобиновая
и оксигемоглобиновая 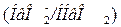 буферные системы ― мощные системы эритроцитов. В качестве донора
буферные системы ― мощные системы эритроцитов. В качестве донора 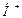 выступают две слабые кислоты: гемоглобин
выступают две слабые кислоты: гемоглобин 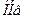 и оксигемоглобин
и оксигемоглобин 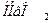 . Роль акцептора
. Роль акцептора 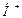 выполняют сопряженные этим кислотам основания, т.е. их анионы
выполняют сопряженные этим кислотам основания, т.е. их анионы 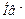 и
и 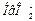 .
.
Механизм буферного действия гемоглобиновых систем основан на следующих реакциях:



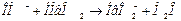 .
.
(нейтрализация кислот) (нейтрализация оснований)
Гемоглобиновые системы крови эффективно функционируют только в сочетании с другими буферными системами крови.






