Буферные растворы
Методические рекомендации
к лабораторно-практическим занятиям
Пермь 2006
Составители: Галинова К.Г., Жвакина М.В., Кожевникова И.А.
Буферные растворы: Методические рекомендации для самостоятельной аудиторной работы студентов/ Сост.
Пермь: ГОУ ВПО «ПГМА Росздрава», 2006 - 23 с.
Методические рекомендации включают краткий теоретической материал по теме, типовые задачи с образцами их решения, лабораторные работы (по получению буферных растворов,влиянию кислот, щелочей и разбавления на рН буферных систем, определению буферной ёмкости растворов), задачи и упражнения для самостоятельной работы, тестовые задания для самоконтроля.
Соответствуют программе, утвержденной Министерством здравоохранения и социального развития РФ, предназначены для студентов 1 курса лечебного, педиатрического, медико-профилактического и стоматологического факультетов.
Рецензенты: зав. кафедрой физической химии ПГФА, профессор Гейн В.А.; доцент кафедры Рюмина Т.Е.
Содержание
1. Введение.................................................................................................................... 4
2. Основные теоретические положения темы........................................................ 5
3. Задачи для самостоятельного решения............................................................ 15
4. Вопросы для самоконтроля................................................................................. 17
5. Тестовые задания для самоконтроля................................................................. 18
6. Лабораторная работа............................................................................................. 21
7. Литература.............................................................................................................. 23
Введение
К числу исключительных свойств живых организмов относится поддержание кислотно-щелочного (протолитического) баланса на необходимом уровне. Это выражается в достаточно постоянных значениях рН биологических сред и в способности восстанавливать рН при поступлении в эти среди кислот и оснований. В процессе жизнедеятельности в организме образуется большое количество кислот и прежде всего углекислоты (до 13 моль ежесуточно), которая в основном выводится из организма при дыхании в виде оксида углерода (IV). Нарушение выделения углекислоты приводит к серьезным патологиям. Согласно расчетам для нарушения кислотно-щелочного баланса у человека достаточно задержки в организме всего 0,15 моль кислоты.
В организме образуются также нелетучие кислоты (серная, фосфорная, молочная и др.) в количестве 0,03-0,08 моль/сут. При некоторых патологических процессах, например, при диабете, нелетучих кислот образуется до 1 моль/сут., в основном это ацетоуксусная и β-оксимасляная кислоты. От этих кислот организм освобождается благодаря мочевыделению.
Основные продукты (азотистые основания, аммиак) образуются в организме в результате метаболизма аминокислот и белков. Они либо включаются в процессы дальнейшего метаболизма, либо выводятся из организма через почки.
С помощью физиологических процессов кислоты и основания выводятся из организма очень медленно, быстрая их нейтрализация и поддержание рН жидких сред на необходимом уровне осуществляется за счет физико-химических процессов, среди которых прежде всего следует отметить протолитическое равновесие в буферных системах.
Тема занятия: Буферные растворы.
Тема важна для изучения последующих дисциплин: биохимия, физиология и др.
Цель занятия: приобрести системные знания по кислотно-основным буферным растворам.
1. Усвоить понятия: буферная система и раствор, буферное действие, буферная емкость.
2. Разобраться в механизме буферного действия
3. Научиться готовить буферные растворы с заданным значением рН, а также рассчитывать рН приготовленных растворов
4. Ставить опыты, выявляющие буферное действие и зависимость буферной емкости от добавления кислоты, щелочи, разведения
5. Усвоить роль буферных систем в поддержании кислотно-щелочного равновесия в организме.
Основные теоретические положения темы
Буферными называют растворы, которые сохраняют практически постоянное значение рН при добавлении к ним небольших количеств кислоты или щелочи и при разбавлении.
Буферное действие растворов обусловлено наличием в них кислотно-основного равновесия общего типа:

Слабая кислота (донор  ) Сопряженное основание (акцептор
) Сопряженное основание (акцептор  )
)

Слабое основание (акцептор  ) Сопряженная кислота (донор
) Сопряженная кислота (донор  )
)
Сопряженные кислотно-основные пары 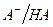 и
и 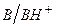 называют буферными системами
называют буферными системами
По принадлежности слабого электролита к классу кислот или оснований буферные системы делятся на кислотные, основные и амфолиты.
Таблица 1






