

Перемещение ионов происходит не только за счет диффузии, но и под действием поля
Способ устранения диффузионного потенциала
Метод солевого мостика:
1) одна граница между двумя растворами замещается двумя
2) на каждой из границ возникает примерно 2 одинаковых диффузионных скачка потенциалов, имеющих разный знак и поэтому взаимокомпенсирующиеся
3) обозначают ||
Диффузионный потенциал – неравновесный потенциал, так как связан с процессами переноса. Точно не определяется и не рассчитывается.
Удельная электропроводность

R – сопротивление (Ом)
ρ – удельное сопротивление (Ом × м или Ом × см)

Удельная электропроводность – электропроводность проводника (раствора, расплава, твердого электролита) заключенного между двумя электродами площадью по 1 м2, расстояние между которыми 1 м
Генератор переменного тока

Если мост находится в состоянии баланса (отсутствует переменное напряжение на клеммах осциллографа О), то выполняется
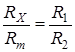
RX – зависит от геометрии ячейки, размеров электродов и расстояния между ними, то сначала определяют константу ячейки
- При увеличении концентрации электролита (сильного) σ увеличивается вследствие увеличения общего числа ионов в растворе. Дальнейший рост концентрации приводит к уменьшению подвижности ионов вследствие их взаимодействия друг с другом.
– σ слабых электролитов ниже σ сильных электролитов вследствие малой диссоциации
Эквивалентная электропроводность
Электропроводность объема раствора электролита, содержащего 1 моль-экв растворенного вещества, находящегося между двумя электродами, расстояние между которыми 1 м.


??????– отражают влияние сил взаимодействия между ионами как функцию межионных расстояний
Закон Кольрауша
Плотность тока, переносимого катионами и анионами

Плотность тока из закона Ома:



Закон Ома: 

λ+ и λ– – ионные электропроводности
При бесконечном разбавлении:

В растворах электролитов катионы и анионы переносят электрический ток независимо друг от друга
Разность предельных эквивалентных электропроводностей связана с различием анионов. Катион не влияет.
Эквивалентная электропроводность сильных и слабых электролитов
– уменьшается с увеличением концентрации вследствие взаимодействия друг с другом
В разбавленных растворах 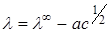
λ∞ предельная эквивалентная электропроводность
а – эмпирический параметр
– для слабых электролитов выражена более сильно из-за уменьшения их степени диссоциации с ростом концентрации


Графическое определение λm∞


Числа переноса
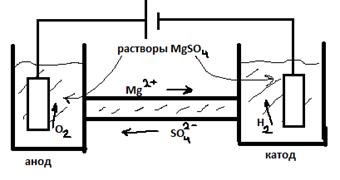
· при прохождении тока через раствор, анионы SO42– переносят в 3 раза больше количества электричества, чем Mg2+
· заряд у них одинаковый, но скорость их перемещения различна
· Для оценки относительного вклада ионов в перенос электрического тока Гитторф ввел понятие – числа переноса
Числа переноса – это отношение количества электричества, перенесенного данным видом ионов к общему количеству электричества, перенесенного всеми ионами

Сумма всех чисел переноса ∑ ti в ионном проводнике равна 1
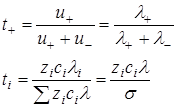
ti – зависит от концентрации электролита, температуры, растворителя
Предельное число переноса: 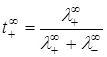
Ионы H+ и OH– обладают повышенной способностью переносить электричество (эстафетный механизм передачи протона)






