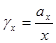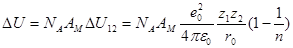
NA – постоянная Авогадро
AM – постоянная Маделунга, учитывает «геометрию» кристалла
Постоянная (константа) Маделунга
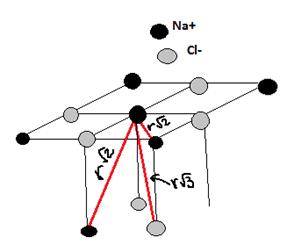
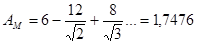
6 ионов Cl– притяжение «+»
12 катионов Na+ отталкивание «–»
8 ионов Cl– Притяжение «+»
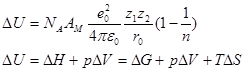
В конденсированных системах энергия электростатического взаимодействия существенно превышает энтропийный фактор TΔS и работу теплового расширения pΔV поэтому ΔU≈ΔG
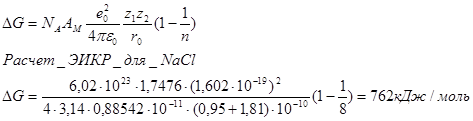
Вывод: разрушение кристаллической решетки при растворении требует очень больших затрат. Эта энергия может быть компенсирована только за счет сольватации.
Энергия сольватации – разность энергий иона в вакууме и в растворе. Относится к 1 моль ионов.
Модель Борна:
1) Ион шарообразный с радиусом r
2) Растворитель рассматривается как сплошная среда (континуум) с диэлектрической проницаемостью ε
3)
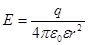
Напряженность – сила, действующая на заряд +1 находящийся на расстоянии r от заряда q.
Напряженность связана с потенциалом: 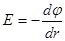
Найдем потенциал на поверхности сферического иона радиусом ri
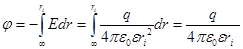
Работа заряжения сферы:
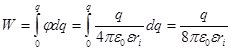
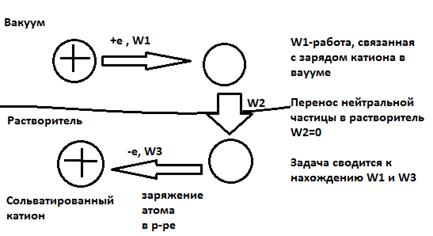
Для работ W1 и W3
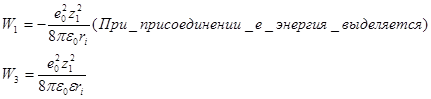
Энергия сольватации по Борну:
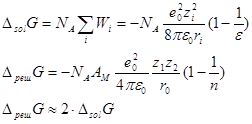
Энергия сольватации по Фрумкину
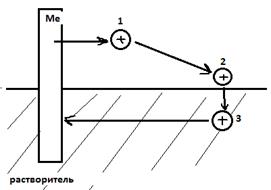
1) Испарим 1 моль атомов металла ΔсубG
2) Ионизируем атом Me ΔионG
3) 1 моль e введем в металл: работа выходы e из Me равна –zWe
4) Ионы Me перенесем в точку 2
NA z e0 Δφ = z F Δφ
5) Перенесем катион Me в раствор. ΔsolG – реальная энергия сольватации
6) Катион Me из раствора в металл
ΔсубG + ΔионG – z We + z F Δφ + ΔsolG = 0
ΔsolG = – ΔсубG – ΔионG + z We – z F Δφ
С увеличение радиуса иона энергия гидратации уменьшается по модулю
Схема гидратации
H+ + H2O → H3O+
ΔsolG=ΔsolH – TΔS
Уравнение Гиббса-Гельмгольца
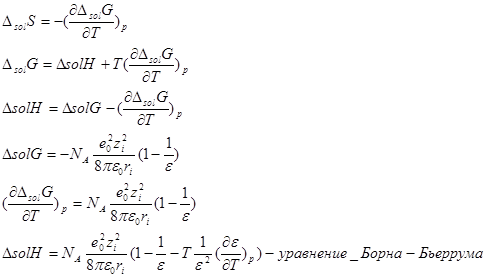
С увеличением радиуса ΔsolH увеличивается по абсолютной величине
Энтропия сольватации
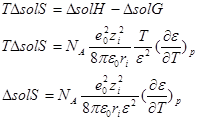
Рассчитанная по модели Борна ΔsolS получается меньше в несколько раз экспериментальной (по абсолютной величине).
Поскольку ε воды уменьшается с ростом температуры формула приводит к отрицательному значению ΔsolS.
Расхождение с экспериментом связано с учетом только кулоновских взаимодействий
Зная ΔsolS гидратации катиона и аниона можно рассчитать ΔsolS солей (< 0).
Отсюда следует, что при введении ионов в воду структура растворителя становится более упорядоченной из-за ориентирующего действия ионов на ближайшие к иону диполи воды
Средние ионные активности
Активность – кажущаяся концентрация компонента в растворе (Льюис)
Коэффициент активности – отношение активности к мольной доле, молярной концентрации или моляльности вещества.