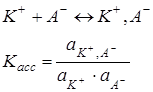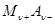
Химический потенциал соли и химический потенциал ионов связаны уравнением
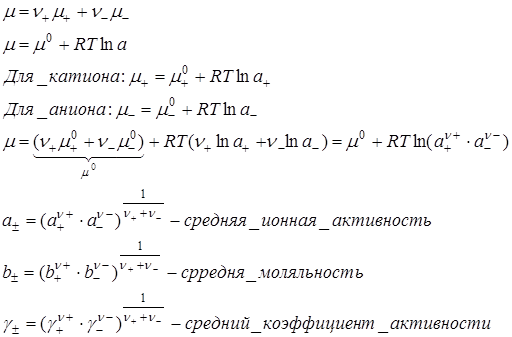
– в эксперименте можно определить только средние ионные коэффициенты активности
– а теории коэффициент активности отдельных частиц рассчитывают
Ряд эмпирических правил (по свойствам электролитов), установленных Льюисом
1) в области низких концентраций средние коэффициенты активности определяются зарядом ионов и практически не зависят от других характеристик
2) Величины среднего коэффициента активности для очень разбавленных растворов зависит от общей концентрации всех присутствующих ионов и их зарядов, но не от природы электролита
Ионная сила раствора:
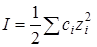
В разбавленных растворах сильных электролитов:
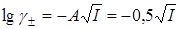 (для 1,1 электролитов A= 0,5)
(для 1,1 электролитов A= 0,5)
Теория Дебая-Хюккеля – теория сильных электролитов:
1) силы взаимодействия ионов в растворах электростатические и могут быть рассчитаны по законам электростатики
2) Влияние растворителя учитывается введением диэлектрической постоянной ε
3) Взаимодействие иона (называется центральным) с окружающими его ионами электролита в среднем равноценно его взаимодействию с воображаемой ионной атмосферой, обладающей непрерывным распределением электрического заряда
4) Размерами центрального иона можно пренебречь и считать его точечным зарядом
5) Взаимодействие с ионной атмосферой понижает энергию Гиббса иона
Вычисляя работу образования ионной атмосферы можно количественно оценить степень отклонения от идеального состояния и найти средний коэффициент активности электролита.
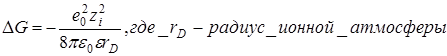
Изменение энергии Гиббса по сравнению с идеальным
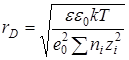
где ni – число ионов в единице объема, rD – расстояние от центрального иона, при котором плотность ионной атмосферы максимальна
Для химического потенциала i-того компонента раствора
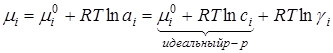
Отклонение реального раствора от идеального обусловлено взаимодействием ионов с ионной атмосферой
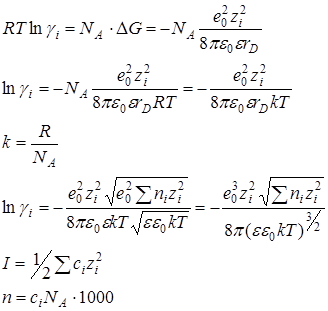
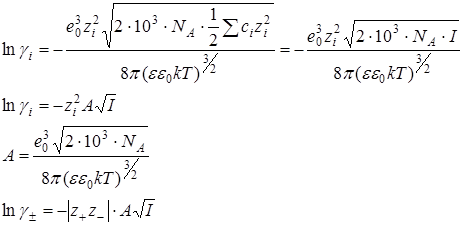
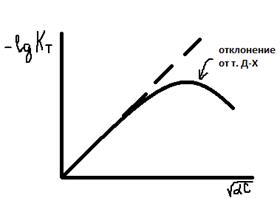
Предельный закон Дебая-Хюккеля (первое приближение)
Достоинства:
1) отсутствие эмпирических постоянных и подгоночных параметров
2) Обоснование правил Льюса-Рендалла
Второе приближение Дебая-Хюккеля
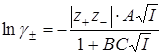
В – величина по своему смыслу соответствует расстоянию до которого могут быть сближены ионы. Однако сольватация делает эту величину неопределенной
Третье приближение Дебая-Хюккеля
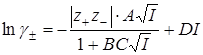
Применение теории Дебая-Хюккеля к слабым электролитам
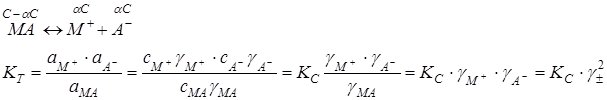
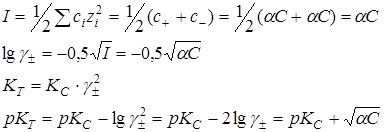
Ионная ассоциация
В.К. Семченко и Н. Бьерум ввели понятие ионной пары (ИП)
В растворах симметричных электролитов (1-1, 2-2, 3-3) ИП в целом не заряжены, но обладает дипольным моментом.
Ионные пары следует отличать от молекул и твердых ионных соединений, так как она стабилизированы взаимодействиями более слабыми, чем ковалентные и ионные связи и расстояние между ядрами атомов в них больше.
В координационной химии ИП и их аналоги – многочастичные ассоциаты – относятся к классу внешнесферных комплексных соединений.
Классификация ИП по структуре сольватных оболочек:
1) Контактные ИП – катион и анион в непосредственном контакте
2) Сольватированные ИП – катион и анион связаны друг с другом через одну молекулу растворителя
3) Сольватно-разделенные (рыхлые) – между катионом и анионом более 1 молекулы растворителя
По числу связанных ионов:
1) бинарные ассоциаты
2) тройники: катионные, анионные, нейтральные
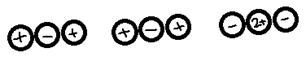
3) квадруполи
Константа ионной ассоциации