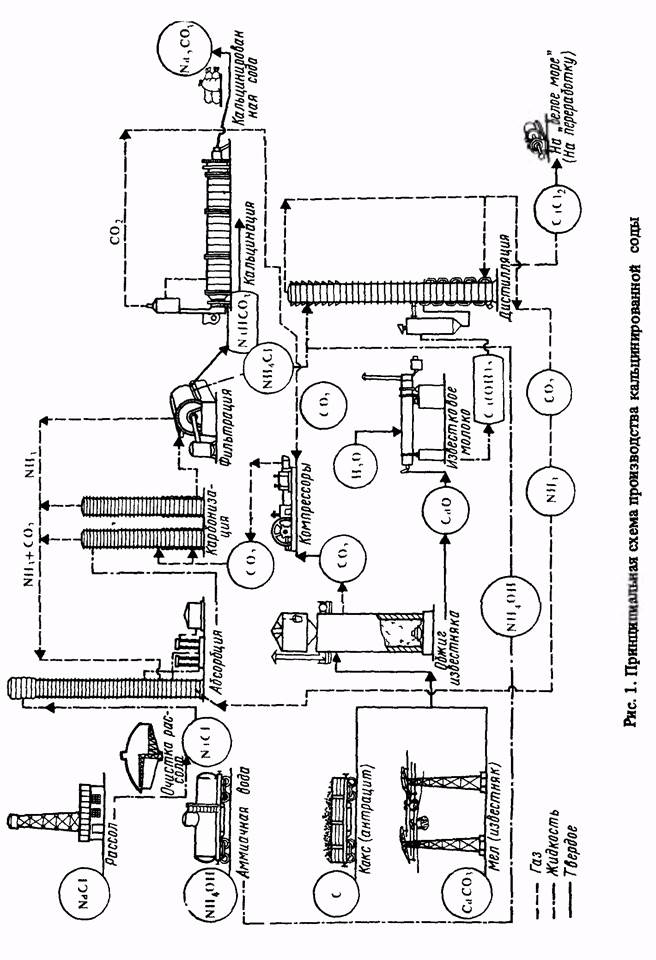
≈ще в 1811 г. физик ‘ренель обнаружил, что при взаимодействии растворенных в воде бикарбоната аммони€ NH4HCO3 и поваренной соли NaCl можно получить осадок бикарбоната натри€ NaHCO3, из которого нагреванием легко получают соду Na2CO3.
ѕроцесс получени€ соды можно представить так:
NH3 + —ќ2 + Ќ2ќ = NЌ4HCO3 (3)
NH4HCO3 + NaCl =NaHCќ3 + NH4C1 (4)
2NaHCќ3 =(160∞)= Na2 CO3 + CO2 + H2ќ (5)
Ќа содовых заводах бикарбонат аммони€ получают непосредственно в водных растворах NaCl, т. е. с химической точки зрени€ первые две реакции объедин€ютс€ в одну:
NaCl + NH3 + —ќ2 + Ќ2ќ = NaHCO3 + NH3Cl (6)
“ак как диоксид углерода плохо раствор€етс€ в воде, в отсутствии аммиака, то практически сначала поглощают аммиак раствором NaCl (рассолом), а затем полученным аммонизированным рассолом поглощают диоксид углерода, т. е. последнюю реакцию (4) провод€т в две ступени. ѕерва€ ступень - поглощение аммиака и частично диоксида углерода - протекает в отделении абсорбции, а втора€ - поглощение —ќ2 - в отделении карбонизации.
¬ыпавший в процессе карбонизации осадок NaHCO3 отфильтровывают на вакуум-фильтрах и по реакции (5) разлагают с получением соды в специальных печах в отделении кальцинации. ¬ыдел€ющийс€ при этом диоксид углерода используют в процессе карбонизации. ќбразующийс€ по реакции (4) хлорид аммони€ может выпускатьс€ в виде дополнительного готового продукта. ќднако практически на всех содовых заводах аммиак из хлорида аммони€ регенерируют и возвращают обратно в производство. — этой целью маточный раствор после вакуум-фильтров, содержащий NH4Cl, обрабатывают на определенном этапе регенерации известковым молоком. ѕри этом протекает реакци€:
2NH4 C1 + —а(ќЌ) 2 = 2NH3 + 2Ќ2ќ + —а—12 (7)
ќбразующийс€ аммиак отгон€ют из раствора вод€ным паром и направл€ют в отделение абсорбции. ќстающийс€ раствор, содержащий хлорид кальци€ и неиспользованный NaCl, называемый дистиллерной жидкостью, €вл€етс€ отбросом производства. –егенераци€ аммиака протекает в отделении дистилл€ции.
ƒл€ получени€ известкового молока необходима известь —аќ, которую на содовых заводах получают путем обжига карбонатного сырь€, т. е. мела или известн€ка, в известково-обжигательных печах. ѕри его нагревании до 1100 - 1200∞ — протекает реакци€:
—а—ќ3= —аќ + —ќ2 (8)
ќбразующийс€ диоксид углерода используют в процессе карбонизации, а известь —аќ гас€т избытком воды с получением известкового молока:
—аќ + Ќ2ќ = —а(ќЌ)2 (9)
Ќа всех содовых заводах в насто€щее врем€ осуществл€ют предварительную очистку сырого рассола от примесей - солей кальци€ и магни€ - при помощи соды и извести. ¬ процессе очистки протекают реакции с образованием плохо растворимых солей Mg(OH)2 и —а—ќ3, выпадающих в осадок. Ќапример:
Mg—12 +—а(OH)2 = Mg(OH)2 +—а—12 (10)
—а—12 + Na2CO3 = CaCO3 + 2NaCl (11)
ќсадки Mg(OH)2 и —а—ќ3 удал€ют методом отстаивани€, а очищенный рассол поступает в производство.
–еакци€ (6) не идет до конца, поэтому в дистиллерной жидкости кроме —а—12 содержитс€ неиспользованный NaCl. Ќа 1 т продукционной соды тер€етс€ около 0,5 т NaCl и образуетс€ около 1 т —а—12. Ёто значит, что в содовые заводы выбрасывают ежегодно до 4,5 млн. т —а—12 и 2,3 млн. т NaCl. Ёти отходы принос€т большой вред расположенным вблизи водоемам и доставл€ют много забот работникам садовой промышленности, кроме того, преп€тствуют рациональному географическому размещению новых заводов.
|
|
|
ѕоиски путей использовани€ отходов содового производства - важна€ народнохоз€йственна€ задача. ќдним из таких путей €вл€етс€ переработка дистиллерной жидкости на технические хлориды натри€ и кальци€ методом выпаривани€.
Ќа заводах прин€ты краткие обозначени€ аппаратов содового производства:
јЅ - 1 - первый абсорбер; јЅ - 2 - второй абсорбер; √» - гаситель извести; ƒ Ѕ - декарбонатор; ƒ— - дистиллер; ƒ—∆ - дистиллер слабой жидкости; ¬Ќ - вакуум-насос; ¬‘Ћ - вакуум-фильтр; »ѕ - известкова€ печь шахтного типа; »— - испаритель; Ћ - карбонизационна€ колонна; Ћѕ - колонна предварительной карбонизации; √ - компрессор газовый; ƒ— - конденсатор дистилл€ции; ќ’ - оросительный холодильник; ќ“ - отстойник; ѕ√»ѕ - промыватель газа известковых печей; ѕ√ Ћ-1 - первый промыватель газа карбонизационных колонн; ѕ√ Ћ-2 - второй промыватель газа карбонизационных колонн; ѕ√—ѕ - промыватель газа содовых печей; ѕ√јЅ - промыватель газа абсорбции; ѕ¬‘Ћ - промыватель воздуха фильтров; —ј– - сборник аммонизированного рассола; —∆‘Ћ - сборник жидкости фильтров; —ѕ - содова€ печь; —ћ - смеситель; “ƒ— - теплообменник дистилл€ции; ’√ƒ— -холодильник газа дистилл€ции; ’√—ѕ - холодильник газа содовых печей.
¬заимна€ св€зь отдельных операций, осуществл€емых на содовых заводах, показана на рис. 1.