≈сли все величины в уравнении разделить или умножить на определенное число, то равенство сохранитс€. –азделим в уравнении все величины на 2.
Ќ2(г) + 0,5ќ2(г) = Ќ2ќ (г) ∆Ќ = - 68,3 кка л/моль (или 242 кƒж/моль)
оличество теплоты, выдел€ющейс€ (или поглощающейс€) при образовании одного мол€ соединени€ из простых веществ, называетс€ теплотой образовани€.
Ќапример, выражение Ђтеплота образовани€ воды равна 68,3 ккал/мольї, означает, что при образовании 18 г (1 моль) воды из простых веществ водорода и кислорода выделитс€ 68,3 ккал теплоты.
ќбратите внимание: в термохимических уравнени€х часто используют дробные коэффициенты.
роме того, величина теплового эффекта зависит не только от природы веществ, но и от их агрегатного состо€ни€, а также от температуры, при которой протекает реакци€. ѕоэтому в термохимических уравнени€х указывают агрегатное состо€ние веществ и измерени€ провод€т всегда при посто€нной температуре 250— и 1 атм давлени€ (стандартные услови€). “акие теплоты образовани€ и сгорани€ называют стандартными. ќни указаны в специальных таблицах. Ёнтальпи€ образовани€ простых веществ принимаетс€ равной нулю
Ќа практике часто используют пон€тие Ђтеплота сгорани€ї, это количество теплоты, выдел€ющейс€ при окислении одного мол€ какого-то соединени€.
Ќапример: —2Ќ2(г) + 2,5ќ2(г) = Ќ2ќ(г) + —ќ2(г) + 310,1 ккал/моль
»ли —2Ќ2(г) + 2,5ќ2(г) = Ќ2ќ(г) + —ќ2(г) ; ∆Ќ = -310,1 ккал/моль
«десь 310,1 ккал/моль - это теплота сгорани€ ацетилена.
ѕользу€сь табличными значени€ми теплоты образовани€ и теплоты сгорани€, можно рассчитать энтальпии различных химических процессов и фазовых превращений. ќснованием дл€ таких расчетов €вл€етс€ закон √есса (1841) Ц еще одна формулировка закона сохранени€ энергии: “епловой эффект (энтальпи€) процесса зависит только от начального и конечного состо€ни€ и не зависит от пути перехода его из одного состо€ни€ в другое. ћатематически это можно записать так:
ΔЌхимической реакции= ΣΔЌпродуктов реакции - Σν∙ΔЌисходных веществ
Ё нтальпи€ химической реакции равна разности сумм энтальпий образовани€ продуктов реакции и исходных веществ с учетом их стехиометрических коэффициентов.
јналогично можно рассчитывать и другие термодинамические потенциалы. ¬ ходе химической реакции энерги€ затрачиваетс€ на разрушение св€зей в исходных веществах и выдел€етс€ при образовании св€зей в продуктах реакции.
—ледовательно, экзотермический эффект реакции свидетельствует о том, что образуютс€ соединени€ с более прочными св€з€ми, чем исходные. ¬ случае эндотермической реакции, наоборот, прочнее исходные вещества.
«акон √есса позвол€ет обращатьс€ с термохимическими уравнени€ми как с алгебраическими, т. е. складывать и вычитать их, если термодинамические функции относ€тс€ к одинаковым услови€м.
Ќапример, диоксид углерода можно получить пр€мым синтезом из простых веществ (I) или в две стадии через промежуточный продукт (II):
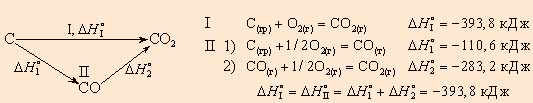
|
| Ёнтальпи€ первого пути равна сумме энтальпий отдельных стадий второго пути |
ѕрактически важным выводом из закона √есса и закона Ћавуазье Ц Ћапласа €вл€етс€ возможность вычисл€ть тепловые эффекты в тех случа€х, когда их нельз€ измерить непосредственно.






