1) при посто€нном объеме Ц изохорные,
2) при посто€нном давлении Ц изобарные,
3) при посто€нной температуре Ц изотермические.
Ёнтальпи€ (Ќ) - это термодинамическа€ функци€, котора€ характеризует энергетическое состо€ние  вещества, но включает в себ€ и внутренн€€ энергию и энергию, затрачиваемую на работу. „аще всего в химии приходитс€ иметь дело с процессами, протекающими при посто€нном давлении. ѕри этом удобно пользоватьс€ величиной энтальпии, определ€емой соотношением:
вещества, но включает в себ€ и внутренн€€ энергию и энергию, затрачиваемую на работу. „аще всего в химии приходитс€ иметь дело с процессами, протекающими при посто€нном давлении. ѕри этом удобно пользоватьс€ величиной энтальпии, определ€емой соотношением: 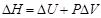 .
.
ƒл€ изохорного процесса (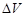 = 0), значит и работа расширени€ равна 0, т.к. ј=–
= 0), значит и работа расширени€ равна 0, т.к. ј=– 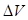 = 0. ѕоэтому дл€ процессов, при которых давление и объем практически не мен€ютс€ изменение энтальпии равно изменению внутренней энергии.
= 0. ѕоэтому дл€ процессов, при которых давление и объем практически не мен€ютс€ изменение энтальпии равно изменению внутренней энергии. 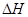 = ΔU = - ΔQ
= ΔU = - ΔQ
¬ литературе можно встретить и другие варианты приведЄнного выше соотношени€, отличающиес€ от него знаками (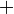 или
или  ). ¬се зависит от того, рассматриваем мы систему с точки зрени€ теплотехники или термохимии. ¬ Ђтермохимическом правиле знаков дл€ теплотыї положительной считают теплоту, отдаваемую системой, а отрицательной Ч теплоту, получаемую системой. “.е. все рассматриваетс€ с точки зрени€ системы. ≈сли в системе уменьшаетс€ внутренн€€ энерги€, значит, она выделилась в виде тепла или работы. ≈сли система получила дополнительную энергию в виде тепла или над системой совершена работа Ц значит, внутренн€€ энерги€ системы стала больше. Ёто значит, что величины ΔU и ΔQ должны иметь противоположные знаки. “епловые эффекты химических реакций можно указывать в химических уравнени€х, и тогда они называютс€ термохимические уравнени€.
). ¬се зависит от того, рассматриваем мы систему с точки зрени€ теплотехники или термохимии. ¬ Ђтермохимическом правиле знаков дл€ теплотыї положительной считают теплоту, отдаваемую системой, а отрицательной Ч теплоту, получаемую системой. “.е. все рассматриваетс€ с точки зрени€ системы. ≈сли в системе уменьшаетс€ внутренн€€ энерги€, значит, она выделилась в виде тепла или работы. ≈сли система получила дополнительную энергию в виде тепла или над системой совершена работа Ц значит, внутренн€€ энерги€ системы стала больше. Ёто значит, что величины ΔU и ΔQ должны иметь противоположные знаки. “епловые эффекты химических реакций можно указывать в химических уравнени€х, и тогда они называютс€ термохимические уравнени€.
ѕоэтому в термохимических уравнени€х мы записываем:
2Ќ2 + ќ2 = 2Ќ2ќ (г) + 136,8 ккал/моль или ∆Ќ = -136,8 ккал/моль,
т.е. в этой реакции энерги€ выдел€етс€ т.к. ΔQ > 0 и энтальпи€ (внутренн€€ энерги€) уменьшаетс€ т.к. 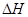 <0.
<0.
≈сли реакци€ протекает с выделением энергии (чаще всего в виде тепла) ΔQ > 0,(и это значит, 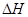 <0 и
<0 и 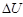 <0), то реакцию называют экзотермической. ≈сли реакци€ протекает с поглощением энергии ΔQ < 0, (и это значит
<0), то реакцию называют экзотермической. ≈сли реакци€ протекает с поглощением энергии ΔQ < 0, (и это значит 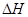 > 0,
> 0, 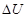 > 0, то ее называют эндотермической. «начит реакци€ образовани€ воды, о которой шла речь выше Ц экзотермическа€.
> 0, то ее называют эндотермической. «начит реакци€ образовани€ воды, о которой шла речь выше Ц экзотермическа€.
≈ще одна формулировка закона сохранени€ энергии это «акон Ћавуазье Ц Ћапласа, который читаетс€ так:
≈сли при образовании какого-либо соединени€ выдел€етс€ (или поглощаетс€) некоторое количество теплоты, то при разложении этого соединени€ в тех же услови€х такое же количество теплоты поглощаетс€ (или выдел€етс€).
2Ќ2(г) + ќ2(г) = 2Ќ2ќ (г) + 136,8 ккал/моль или ∆Ќ = -136,8 ккал/моль
«начит 2Ќ2ќ (г) = 2Ќ2 (г) + ќ2(г) - 136,8 ккал/моль или ∆Ќ = 136,8 ккал/моль






