Электродиализатор, применяющийся в данной работе, состоит из трех П-образных рам и двух сплошных крайних пластин, скрепленных болтами. Мембраны вставляют между двумя резиновыми прокладками, вырезанными по форме рам. Катодом служит никелевая пластина, анодом – графит. Диализатор хранят заполненным водопроводной водой, чтобы не допустить пересыхания ионитовых мембран. Поэтому, подняв крышку диализатора на мешалке, необходимо вылить в раковину содержимое всех камер диализатора. Затем, используя мерный цилиндр, в среднюю камеру наливают 300 мл раствора KCl, полученного в лаборантской и подлежащего очистке от электролита; боковые электродные камеры заполняют дистиллированной водой по уровню средней камеры диализатора.
Перед заполнением средней камеры рабочим раствором определяют исходную концентрацию электролита. Раствор KCl (5 мл), взятый из конической колбы с задачей, по желанию разбавляют водой и титруют 0,01 М раствором AgNO3 в присутствии индикатора K2CrO4 (метод Мора). Все отходы от титрования сливают в темные банки с надписью “слив Ag”. Найденную концентрацию задачи проверяют в лаборантской (в нашем случае объем нитрата серебра, пошедший на титрование, равен 8.2 мл; тогда  = 1.64.10-2 М = 16.4 ммоль/л).
= 1.64.10-2 М = 16.4 ммоль/л).
После сборки установки проверяют правильность подключения электродов у преподавателя и следят, чтобы лопасти мешалки находились примерно по центру камеры с электролитом, затем пропускают постоянный ток. Далее через каждые 15 минут, не выключая ток и мешалку, и отмечая одновременно показания амперметра, производят отбор одной пробы пипеткой из средней камеры диализатора. Титруют аликвоту точно так же, как и исходный раствор. Экспериментальные данные заносят в таблицу 39.1.
Таблица 39.1.
| Длительность электродиализа, ч | Сила тока I, А | Средняя сила тока Iср, А | Количество электричества Q, А.ч | Концентрация раствора в средней камере, ммоль/л | |
| за время Dt | за все время опыта | ||||
| 16.4 | |||||
| 0.25 | 0.08 | 0.04 | 0.01 | 0.01 | 14.4 |
| 0.5 | 0.23 | 0.155 | 0.03875 | 0.04875 | 9.3 |
| 0.75 | 0.30 | 0.265 | 0.06625 | 0.115 | 4.8 |
| 1.0 | 0.25 | 0.275 | 0.06875 | 0.18375 | 2.0 |
| 1.25 | 0.12 | 0.185 | 0.04625 | 0.230 | 0.6 |
| 1.5 | 0.01 | 0.065 | 0.01625 | 0.24625 | 0.35 |
Для вычисления прошедшего количества электричества в А.ч берут среднюю силу тока 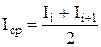 , соответствующую промежуткам времени между соседними измерениями, и умножают на время Dt в часах, т.е. в случае проб, берущихся через каждые 15 мин, на 0,25. Чтобы рассчитать количество электричества за все время опыта, суммируют значения Q за Dt к данному моменту опыта.
, соответствующую промежуткам времени между соседними измерениями, и умножают на время Dt в часах, т.е. в случае проб, берущихся через каждые 15 мин, на 0,25. Чтобы рассчитать количество электричества за все время опыта, суммируют значения Q за Dt к данному моменту опыта.
Строят график (рис. 39.1), на котором по оси абсцисс откладывают количество прошедшего электричества от начала опыта (в А.ч), а по оси ординат – концентрацию раствора в средней камере в момент взятия проб, причем на оси ординат отмечают концентрацию исходного раствора.
 |
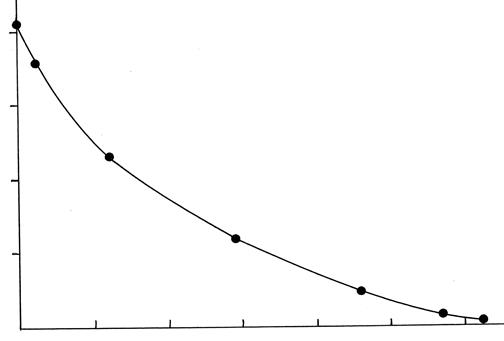
Рис.39.1. Зависимость концентрации раствора в средней камере диализатора
от количества прошедшего электричества.
Кажущийся выход по току hкаж вычисляют по уравнению 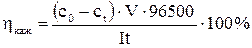 , где c0 и ct –концентрации раствора до и после электродиализа, М; V – объем раствора в средней камере диализатора, л; I – сила тока, А; t – длительность электродиализа, сек.
, где c0 и ct –концентрации раствора до и после электродиализа, М; V – объем раствора в средней камере диализатора, л; I – сила тока, А; t – длительность электродиализа, сек.
Если количество прошедшего электричества Q выражать в А×ч, объем раствора V – в л, концентрацию c0 и ct – в ммоль/л, то 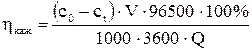 =
=  . В нашем случае
. В нашем случае 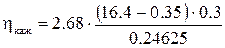 = 52.4%. Чем больше величина кажущегося выхода по току, тем эффективнее процесс электродиализа.
= 52.4%. Чем больше величина кажущегося выхода по току, тем эффективнее процесс электродиализа.






