÷ель работы: познакомитьс€ с пон€тием химического эквивалента, определить мол€рную массу химического эквивалента цинка методом вытеснени€ водорода.
ќборудование и реактивы: прибор дл€ определени€ мол€рной массы эквивалента металла (см. рис. 1), термометр, барометр, 25%-ный раствор сол€ной кислоты, металлический цинк.
“≈ќ–≈“»„≈— »≈ ѕќя—Ќ≈Ќ»я
’имическим эквивалентом (Ё) называетс€ реальна€ или условна€ частица вещества, котора€ может замещать, присоедин€ть, высвобождать или быть каким-либо другим способом эквивалентна (равноценна) одному иону водорода в кислотно-основных и обменных реакци€х, либо одному электрону в окислительно-восстановительных реакци€х.
–еальные частицы - это атомы, ионы, молекулы и т.д., а условные частицы - это, например, 1/2 (H2SO4), 1/4(—), 1/3(Fe3+).
¬ общем случае эквивалент любого вещества X может быть записан в виде Ё’ =1/z(X), где z - число эквивалентности, или эквивалентное число, которое всегда > 1. ќно показывает, сколько эквивалентов содержитс€ в одной формульной единице вещества.
ƒл€ данного вещества z находитс€ по конкретной реакции. ¬ окислительно-восстановительных процессах z определ€етс€ числом электронов, прин€тых или отданных одной формульной единицей вещества, например, в реакции:
Mg + 2HCl → MgCl2 + H2
Z(Mg)=2, т.к. магний в ходе окислительно-восстановительной реакции отдает 2 электрона, а ЁMg =½ (Mg). ¬ обменных процессах Z определ€етс€ стехиометрией и равно знаменателю правильной дроби, котора€ получаетс€ при делении коэффициента перед веществом на самый большой коэффициент в реакции:
јI2O3 + 6HCI =2AICI3 +3H2O
Z (јI2O3) = 6, т.к. при делении коэффициента перед јI2O3 на самый большой коэффициент в реакции - 6, получаетс€ правильна€ дробь 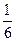 , знаменатель которой равен 6; Z(HCI) = 1, т.к. при делении коэффициента перед HCI на самый большой коэффициент в реакции - 6, получаетс€ 1.
, знаменатель которой равен 6; Z(HCI) = 1, т.к. при делении коэффициента перед HCI на самый большой коэффициент в реакции - 6, получаетс€ 1.
огда речь не идет о конкретной реакции, при определении z дл€ сложных веществ можно воспользоватьс€ следующими правилами:
1) дл€ оксидов z равно числу атомов элемента, умноженному на степень окислени€ элемента;
2) дл€ кислот z равно основности кислоты;
3) дл€ оснований z равно кислотности основани€;
4) дл€ солей z равно числу катионов металла, умноженному на зар€д катиона.
оличество вещества эквивалента обозначаетс€ vЁ,единица измерени€ - моль. ќдин моль эквивалента вещества содержит 6,022-1023 эквивалентов.
ћол€рна€ масса эквивалента MЁ - это масса 1 моль эквивалентов вещества, измер€етс€ в г/моль.
—в€зь между мол€рной массой эквивалента, количеством вещества эквивалента, массой и мол€рной массой вещества выражаетс€ соотношени€ми:
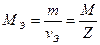

Ёкспериментальное определение мол€рной массы химического эквивалента цинка в данной работе основано на законе эквивалентов:






