Кислоты Бренстеда.
Сила кислоты зависит от природы атома при кислотном центре и от его структурного окружения. Для оценки относительной силы кислот важны такие характеристики атома при кислотном центре как его электроотрицательность и поляризуемость.
При прочих равных условиях для элементов одного периода с ростом электроотрицательности атома кислотность соединений увеличивается, так как высокая электроотрицательность атома при кислотном центре стабилизирует образующийся при отщеплении протона анион. Так, кислотность уменьшается в ряду:
OH-кислоты> NH-кислоты> CH-кислоты
| CH3O-H | CH3NH-H | CH3CH2-H | |
| pKa |
Электроотрицательность атома зависит не только от его природы, но и от типа гибридизации и возрастает по мере увеличения s-характера гибридных орбиталей. Параллельно возрастает кислотность соединений:
| СH3CH2-H | CH2=CH-H | 
| |
| pKa |
Для элементов одной подгруппы с возрастанием заряда ядра кислотность соединений увеличивается:
OH-кислоты < SH-кислоты
| CH3O-H | CH3S-H | |
| pKa | 16,0 | 10,5 |
Увеличение кислотности соединений, несмотря на снижение электроотрицательности атомов в подгруппе, связано с увеличением их поляризуемости по мере возрастания радиуса атома. Большая поляризуемость атома способствует лучшей делокализации отрицательного заряда и повышению стабильности сопряженного основания.
При одинаковой природе атома при кислотном центре сила кислоты определяется его структурным окружением. Увеличению силы кислоты способствует делокализация отрицательного заряда в сопряженном основании (анионе) и его рассредоточение на большем количестве атомов.
Так, карбоновые кислоты – одни из самых сильных органических кислот. Их сила обусловлена стабилизацией карбоксилат-аниона за счет делокализации отрицательного заряда в сопряженной системе. В результате отрицательный заряд в карбоксилат-анионе рассредоточен между двумя атомами кислорода, а обе связи С-O абсолютно равноценны:

Фенолы являются более сильными кислотами, чем спирты, за счет резонансной стабилизации фенолят-аниона, отрицательный заряд которого делокализован по ароматическому кольцу:

В результате по силе органические OH-кислоты могут быть расположены в следующий ряд:
| ROH | < | H2O | < | ArOH | < | RCOOH | |
| pKa | 16-17 | 15,7 | 8-11 | 4-5 |
Введение заместителя в связанный с кислотным центром углеводородный радикал влияет на силу кислоты. Электроноакцепторные заместители увеличивают, а электронодонорные - уменьшают кислотность. Влияние электроноакцепторных заместителей связано с их способностью делокализовать отрицательный заряд и, тем самым стабилизировать сопряженное основание (анион). Влияние электронодонорных заместителей, напротив, приводит к дестабилизации аниона.
Электроноакцепторные заместители увеличивают силу алифатических и ароматических карбоновых кислот, электронодонорные заместители действуют в противоположном направлении:
| Cl-CH2-COOH | H-COOH | CH3-COOH | |||||
| pKa | 2,8 | 3,7 | 4,7 | ||||

| 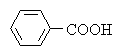
| 
| |||||
| +M > -I | -M и –I | ||||||
| pKa | 4,47 | 4,20 | 3,43 | ||||
Аналогичное влияние оказывают заместители на кислотность спиртов и фенолов.
Основания Бренстеда.
При одинаковом структурном окружении для элементов одного периода с ростом электроотрицательности атома при основном центре основность соединений уменьшается:
аммониевые основания > оксониевые основания
| ROH | RNH2 | |

| ~2 | ~10 |
Снижение основности связано с тем, что более электроотрицательный атом прочнее удерживает неподеленную пару электронов, которую он должен отдать на образование связи с протоном.
Увеличения s-характера гибридных орбиталей приводит к снижению основности:

Для элементов одной подгруппы с возрастанием заряда ядра основность уменьшается:
оксониевые основания > сульфониевые основания
Введение электронодонорных заместителей увеличивает, а введение электроакцепторных - понижает основность. Так, электронодонорные заместители увеличивают основность алифатических и ароматических аминов, увеличивая склонность электронной пары азота к атаке протона. Электроноакцепторные заместители, напротив, снижают электронную плотность неподеленной пары электронов азота и делают ее менее восприимчивой для атаки протоном:
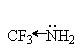
| 
| 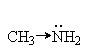
| 
| |

| 9,2 | 10,6 | 10,7 |
Если свободная пара электронов азота находится в сопряжение с двойной связью или ароматическим кольцом, основность снижается. Так, в анилине свободная пара электронов азота сопряжена с ароматическим кольцом.

Протонирование анилина приводит к нарушению сопряжения и энергетически менее выгодно, чем протонирование алифатических аминов.

| 
| 
| |

| 10,6 | 4,6 | 0,9 |
Амиды карбоновых кислот являются очень слабыми основаниями из-за сопряжения пары электронов азота с карбонильной группой. В результате атом азота приобретает частичный положительный, а атом кислорода – частичный отрицательный заряд, и протонирование амидов происходит, как правило, по атому кислорода.

Основность азотсодержащих гетероциклических соединений также определяется доступностью пары электронов азота для атаки протона. Высокой основностью обладают насыщенные азотсодержащие гетероциклы, в которых атом азота находится в состоянии sp3-гибридизации. Основность пиридиниевого атома азота (sp2-гибридизация) ниже. Наконец, пиррольный атом азота практических лишен основных свойств, так как его протонирование означает разрушение ароматической гетероциклической системы:

| 
| 
| |
| pKa | 11,27 | 5,2 | - 0.3 |






