Як відомо, лізил-тРНК-синтетаза у клітині існує у вигляді двох ізоформ: цитозольної та мітохондріальної. Цитозольна ізоформа, яка входить до складу мультисинтетазного комплексу, має більшу молекулярну масу (Рис. 4.6).
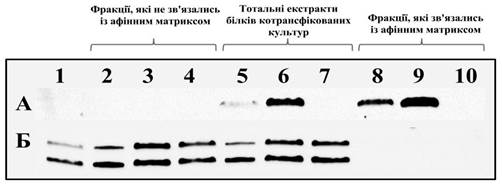
Рис. 4.6. Імуноблотограми екстрактів трансфікованих клітин HeLa і білкових фракцій після інкубації з афінним матриксом Affinity gel Anti-Flag M2, отриманих з використанням Anti-Flag M2 антитіл (А) та IgG anti cKRS DN антитіл (Б)
Доріжки: 1 — загальний екстракт білків нетрансфікованої культури;
2, 5, 8 — культури клітин, котрансфікованих векторами pc5FLAG/TUSC4 та pSG5;
3, 6, 9 — культури клітин, котрансфікованих векторами pc5FLAG/TUSC4 та pCMV6-XL5/KRS;
4, 7, 10 — культури клітин, котрансфікованих векторами pc5FLAG та pCMV6-XL5/KRS.
На імуноблотограмах загальних екстрактів клітин видно, що кількість синтетази збільшувалась у зразках, що були трансфіковані вектором pCMV6-XL5/KRS (Рис. 4.6, доріжки 6 та 7), у порівнянні з екстрактами не трансфікованих клітин (Рис. 4.6, доріжка 1) та трансфікованих плазмідою, що не містила відкритої рамки зчитування KRS (Рис. 4.6, доріжка 5). Це свідчить про нормальну експресію екзогенних векторів. У жодній із фракцій, які були елюйовані із афінного матриксу, не виявлено АРСази при великій кількості NPRL2 (Рис. 4.6, доріжки 8, 9 та 10). Це є доказом того, що лізил-тРНК-синтетаза також не взаємодіє із NPRL2.
Ідентифікація взаємодії між р43, несинтетазним компонентом макромолекулярного комплексу MARS, та білком NPRL2
Аналіз екстрактів клітин після котрансфекції векторами pc5FLAG/TUSC4 та pCMV6-XL5/р43 методом імуноблотингу показав, що екзогенна ДНК добре експресується за умов, описаних вище.
 |
Рис. 4.6. Імуноблотограми екстрактів трансфікованих клітин HeLa і білкових фракцій після інкубації з афінним матриксом Affinity gel Anti-Flag M2, отриманих з використанням Anti-Flag M2 антитіл (А) та IgG anti p43 антитіл (Б)
Доріжки: 1 — загальний екстракт білків нетрансфікованої культури;
2, 5, 8 — культури клітин, котрансфікованих векторами pc5FLAG/TUSC4 та pSG5;
3, 6, 9 — культури клітин, котрансфікованих векторами pc5FLAG/TUSC4 та pCMV6-XL5/р43;
4, 7, 10 — культури клітин, котрансфікованих векторами pc5FLAG та pCMV6-XL5/р43.
Про це свідчить більша кількість білка у загальному екстракті, отриманому із трансфікованих клітин (Рис. 4.7, доріжки 6 та 7) по відношенню до екстракту із нетрансфікованих (Рис. 4.7, доріжка 1) та клітин трансфікованих вектором, що не містив послідовності р43 (Рис. 4.7, доріжка 5). У всіх трьох випадках, фракції білків, що зв’язались із афінним матриксом не містили компонента комплексу MARS, про що свідчить відсутність сигналу при їх аналізі (Рис. 4.7, доріжки 8, 9 та 10).
ВИСНОВКИ
Отримані результати є першими даними роботи з пошуку елементів зв'язку mTOR-сигнального шляху із компонентами апарату трансляції.
1. В ході експерименту підібрано умови для трансфекції культури клітин HeLa плазмідними векторами, що кодували метіоніл-тРНК-синтетазу (pCMV6-XL5/MRS), глутамініл-тРНК-синтетазу (pCMV6-XL5/QRS), лізил-тРНК-синтетазу (pCMV6-XL5/KRS), аспартил-тРНК-синтетазу (pCMV6-XL5/DRS), білок р43 (pCMV6-XL5/p43), білок NPRL2 (pc5FLAG/TUSC4) з метою оптимізації рівня експресії екзогенної ДНК.
2. Показано, що метіоніл-, глутамініл-, лізил-, аспартил-тРНК-синтетази та білок р43 не утворюють стабільних комплексів з білком NPRL2 in vivo за описаних умов проведення експерименту
3. Виявлено, що метіоніл-тРНК-синтетаза неспецифічно взамодіє із афінним матриксом Affinity gel Anti-Flag M2 і тому для перевірки її взаємодії з білком NPRL2 необхідно оптимізувати умови проведення афінної хроматографії.






