| онц. розчину сол≥, % | MgSO4 | K2Cr2O7 |
| 1,008 | 1,0052 | |
| 1,019 | 1,0122 | |
| 1,030 | 1,0193 | |
| 1,039 | 1,0264 | |
| 1,050 | 1,0336 | |
| 1,060 | 1,0408 | |
| 1,071 | 1,0481 | |
| 1,082 | 1,0554 | |
| 1,093 | 1,0628 | |
| 1,103 | 1,0703 | |
| 1,115 | 1,0779 | |
| 1,126 | 1,0855 |
≤≤. ¬изначенн€ мол€рноњ та нормальноњ концентрац≥й розчину з певною масовою часткою.
ћол€рна концентрац≥€ (мол€рн≥сть розчину), —ћ (моль/л або ћ)Ц к≥льк≥сть моль розчиненоњ речовини, €ка м≥ститьс€ в 1 л (1000 мл) розчину:
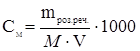 , зв≥дки
, зв≥дки 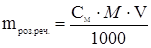 ,
,
де mроз.реч . Ц маса розчиненоњ речовини, г;
ћ Ц мол€рна маса розчиненоњ речовини, г/моль;
V Ц обТЇм розчину, мл.
Ќормальна концентрац≥€ (мол€рна концентрац≥€ екв≥валента, нормальн≥сть розчину) —Ќ (екв/л або н) Ц к≥льк≥сть екв≥валент≥в речовини, €ка м≥ститьс€ в 1 л (1000 мл) розчину:
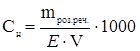 , зв≥дки
, зв≥дки 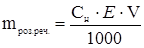 ,
,
де mроз.реч. Ц маса розчиненоњ речовини, г;
≈ Ц екв≥валентна маса, г/моль; VЦ обТЇм розчину, мл.
¬ище наведен≥ формули вираженн€ концентрац≥њ розчиненноњ речовини поЇднують наступним чином:
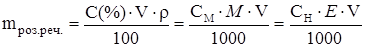
¬икористовуючи зазначен≥ формули, визначити мол€рну та нормальну концентрац≥ю розчину певноњ масовоњ частки за ≥ндив≥дуальним завданн€м.
онтрольн≥ питанн€.
1. ќбчислити маси натр≥й хлориду ≥ води дл€ приготуванн€ 250 г 4%-го розчину.
2. ќбчислити маси м≥дного купоросу CuSO4∙5H2O ≥ води, €к≥ необх≥дн≥ дл€ приготуванн€ 500 г 2%-го розчину CuSO4. ќбчислити його мол€рну ≥ нормальну концентрац≥њ, €кщо густина дор≥внюЇ 1,015 г/см3.
3. який обТЇм 0,1 н розчину можна одержати з 0,2 л 2 н розчину н≥тратноњ кислоти?
4. ¬изначити, ск≥льки потр≥бно води та 40%-го розчину лугу дл€ приготуванн€ 600 г 12%-го розчину.
5. –озрахуйте мол€рну, нормальну та мол€льну концентрац≥њ розчину з масовою часткою H2SO4 56% (r=1,46 г/см3).
Ћабораторна робота є7
¬ластивост≥ розчин≥в електрол≥т≥в
ќсновн≥ теоретичн≥ питанн€.
—ильн≥ та слабк≥ електрол≥ти, њх дисоц≥ац≥€. ќборотн≥ та необоротн≥ реакц≥њ. ћолекул€рн≥ та йонн≥ р≥вн€нн€ у повному ≥ скороченому вигл€д≥. «наченн€ рЌ розчин≥в.
ћета роботи: досл≥дити властивост≥ розчин≥в електрол≥т≥в; визначити фактори, €к≥ впливають на силу кислот ≥ луг≥в; зТ€сувати умови утворенн€ ≥ розчиненн€ осад≥в.
ќбладнанн€ ≥ реактиви: прилад дл€ досл≥дженн€ електропров≥дност≥ розчин≥в; розчини електрол≥т≥в та неелектрол≥т≥в, наб≥р ≥ндикатор≥в: лакмус, метилоранж, фенолфталењн; розчини кислот ≥ луг≥в з на€вних у лаборатор≥њ.
’≥д роботи
ƒосл≥д 1. ƒосл≥дженн€ електропров≥дност≥ розчин≥в електрол≥т≥в. —ильн≥ та слабк≥ електрол≥ти.
ƒл€ досл≥дженн€ використовуЇтьс€ прилад, що складаЇтьс€ з граф≥тових електрод≥в, включених у ланцюг посл≥довно з ламповим реостатом. ѓх занурюють у скл€нку, €ку заповнюють по черз≥ розчинами: дистильованоњ та водопров≥дноњ води H2O; цукру C12H22O11; етилового спирту C2H5OH; хлоридноњ кислоти HCl; натр≥й г≥дроксиду NaOH; кал≥й н≥трату KNO3. ќкремо досл≥дити електропров≥дн≥сть концентрованих ≥ розбавлених розчин≥в оцтовоњ кислоти ≥ амон≥й г≥дроксиду.
|
|
|
¬≥дм≥тити, у €ких розчинах лампочка горить або не горить, €скраво чи тьм€но. —класти р≥вн€нн€ дисоц≥ац≥њ електрол≥т≥в. «а ступенем розжарюванн€ електричноњ лампи зробити висновок про њх силу. як≥ сполуки в≥днос€тьс€ до неелектрол≥т≥в?
ƒосл≥д 2. «абарвленн€ ≥ндикатор≥в у р≥зних середовищах.
ƒл€ досл≥дженн€ вз€ти розчини: дистильовану H2O (нейтральне середовище), NaOH (лужне середовище), H2SO4 (кисле середовище) та ≥ндикатори: метилоранж, лакмус, фенолфталењн (у розчин≥ або у вигл€д≥ ≥ндикаторного паперу). —ередовище кожного розчину досл≥дити за допомогою ≥ндикатор≥в, записати спостереженн€. якщо в лаборатор≥њ Ї ун≥версальний ≥ндикатор з визначеними значенн€ми рЌ, можна в≥дм≥тити наближене значенн€ рЌ у кожному з цих розчин≥в. Ќаписати р≥вн€нн€ електрол≥тичноњ дисоц≥ац≥њ кислоти ≥ лугу у розчин≥. «робити висновок, €к≥ йони визначають кисле або лужне середовище, €ке середовище Ї нейтральним.
ƒосл≥д 3. –еакц≥њ обм≥ну у розчинах електрол≥т≥в.
якщо у ход≥ реакц≥њ утворюЇтьс€ осад, газ, вода або ≥нш≥ малодисоц≥йован≥ речовини, так≥ реакц≥њ Ї необоротними ≥ проход€ть в одному напр€мку. якщо ж вс≥ реагенти Ї розчинами сильних електрол≥т≥в, так≥ реакц≥њ не доход€ть до к≥нц€ та Ї оборотними.
а) –еакц≥њ з утворенн€м малорозчинних сполук.
” дв≥ проб≥рки внести по 1 мл розчин≥в солей CuSO4 та FeCl3 ≥ додати по 1мл розчину натр≥й г≥дроксиду NaOH. який кол≥р осад≥в у проб≥рках? —класти молекул€рно-йонн≥ р≥вн€нн€ реакц≥й.
ƒосл≥д повторити, наливши у проб≥рки розчини Na2SiO3 та CH3COONa, додати по 1 мл хлоридноњ кислоти Ќ—1. —постер≥гати утворенн€ осаду золю метакремн≥Ївоњ кислоти (H2SiO3)n та слабкоњ оцтовоњ кислоти CH3COOH (за характерним запахом). «аписати р≥вн€нн€ реакц≥й у молекул€рному та йонному вигл€д≥.
¬ першу проб≥рку до 1 мл розчину сол≥ BaCl2 додати 1мл розчину натр≥й сульфату Na2SO4: в друг≥й проб≥рц≥ зм≥шати по 1 мл розчин≥в купрум сульфату CuSO4 та натр≥й сульф≥ду Na2S. «аписати спостереженн€. —класти молекул€рно-≥онн≥ реакц≥њ процес≥в.
б) –еакц≥њ з утворенн€м газ≥в.
” проб≥рку внести на к≥нчику шпател€ кристал≥чний натр≥й карбонат Na2CO3 ≥ додати хлоридну кислоту Ќ—1. —постер≥гати утворенн€ газу. «аписати р≥вн€нн€ реакц≥њ у молекул€рному та йонному вигл€д≥.
в) –еакц≥њ з утворенн€м слабких електрол≥т≥в.
Ќалити в проб≥рку 2-3 мл 2 н розчину лугу ≥ додати краплю фенолфталењну. ¬ €кий кол≥р забарвивс€ ≥ндикатор? „ому? ѕот≥м в проб≥рку влити 2 н розчин хлоридноњ кислоти до знебарвленн€ розчину. ѕо€снити причину знебарвленн€. Ќаписати молекул€рне ≥ йонне р≥вн€нн€ реакц≥њ нейтрал≥зац≥њ лугу кислотою.
онтрольн≥ питанн€:
1. ƒати визначенн€ кислот, основ ≥ солей у св≥т≥ теор≥њ електрол≥тичноњ дисоц≥ац≥њ. —класти р≥вн€нн€ дисоц≥ац≥њ сполук: HCl, H2CO3, Na2CO3, Ca(OH)2, ZnSO4, KHSO3, CuOHNO3, MgCl2.
2. ѕо€снити, у €кому випадку реакц≥њ м≥ж розчинами електрол≥т≥в прот≥кають до к≥нц€. «аписати молекул€рн≥ та йонн≥ р≥вн€нн€ можливих реакц≥й:
NaOH + HCl → 2SO4 + Na—≤ →
ZnOHCl + HCl → CuCl2 + AgNO3 →.
3. ќбчислити: а) рЌ 0,01 ћ розчину Ќ—1; б) мол€рну концентрац≥ю розчину H2SO4, €кщо його рЌ = 2.
4. Ќавеcти к≥лька молекул€рних р≥вн€нь дл€ реакц≥й, €к≥ мають наступн≥ скорочен≥ йонн≥ р≥вн€нн€:
Pb2+ + 2ClЦ = PbCl2↓ Mg2+ + 2OHЦ = Mg(OH)2↓
5. Ќапиш≥ть молекул€рн≥ р≥вн€нн€ реакц≥й м≥ж такими речовинами у розчинах: CaCl2 та (NH4)2CO3; CuSO4 та Na2CO3; Ca(NO3)2 та Na2CO3; CaBr2 та K2CO3. ¬ чому пол€гаЇ суть цих реакц≥й? яким одним ≥онним р≥вн€нн€м вс≥ вони можуть бути виражен≥?
|
|
|
Ћабораторна робота є8
¬одневий показник рЌ. √≥дрол≥з солей
ќсновн≥ теоретичн≥ питанн€.
≈лектрол≥тична дисоц≥ац≥€ молекул води. ≤онний добуток води. ¬одневий показник рЌ в нейтральних, кислих ≥ лужних розчинах.
¬заЇмод≥€ солей з водою при розчиненн≥. ¬плив температури на г≥дрол≥з. √≥дрол≥з солей р≥зних тип≥в. –еакц≥€ середовища при г≥дрол≥з≥.
ћета роботи: досл≥дженн€ процесу г≥дрол≥зу солей ≥ встановленн€ фактор≥в, €к≥ впливають на г≥дрол≥з.
ќбладнанн€ ≥ реактиви: розчини солей з на€вних у лаборатор≥њ; наб≥р ≥ндикатор≥в.
’≥д роботи
ƒосл≥д 1. ¬изначенн€ реакц≥њ середовища розчин≥в солей при г≥дрол≥з≥.
Ќа ун≥версальн≥ ≥ндикаторн≥ пап≥рц≥ нанести по краплин≥ розчин≥в р≥зних солей: Na2CO3, Na2S, NH4Cl, ZnSO4, NaCl, K2SO4 та ≥нших на€вних в лаборатор≥њ.
«аписати спостереженн€, вказати реакц≥ю середовища за кольором ≥ наближене значенн€ рЌ за шкалою ун≥версального ≥ндикатору. —класти р≥вн€нн€ реакц≥й у молекул€рно-≥онному вигл€д≥.
«робити висновок про залежн≥сть г≥дрол≥зу сол≥ в≥д природи кислот ≥ основ, €к≥ њњ утворили.
ƒосл≥д 2. ¬изначенн€ продукт≥в г≥дрол≥зу.
” проб≥рку налити 1 мл розчину FeCl3 ≥ внести на к≥нчику шпател€ порошок магн≥ю. —постер≥гати вид≥ленн€ водню. —класти молекул€рне ≥ йонне р≥вн€нн€ г≥дрол≥зу ферум(≤≤≤) хлориду; взаЇмод≥њ магн≥ю з одним з продукт≥в (€ким?) г≥дрол≥зу.
јналог≥чний досл≥д можна зробити при взаЇмод≥њ гранули цинку з гар€чим розчином цинк сульфату.
ƒосл≥д 3. «алежн≥сть ступен€ г≥дрол≥зу в≥д температури.
Ќалити у проб≥рку 1 мл розчину натр≥й ацетату CH3COONa ≥ 2 краплини фенолфталењну. ¬≥дм≥тити кол≥р розчину. Ќагр≥ти проб≥рку на кипл€ч≥й вод€н≥й бан≥ або у полумТњ пальника. «аписати, що спостер≥гаЇтьс€. ќхолодити розчин ≥ в≥дм≥тити зм≥ну забарвленн€. —класти р≥вн€нн€ г≥дрол≥зу натр≥й ацетату. «робити висновок про вплив температури на г≥дрол≥з.
ƒосл≥д 4. ѕовний г≥дрол≥з солей.
” проб≥рку внести по 1 мл розчин≥в алюм≥н≥й сульфату Al2(SO4)3 ≥ натр≥й карбонату Na2CO3. ¬≥дм≥тити утворенн€ драглистого осаду г≥дроксиду алюм≥н≥ю ≥ бульбашок д≥оксиду карбону —ќ2. —класти молекул€рне р≥вн€нн€ цього процесу, €кий прот≥каЇ у дв≥ стад≥њ. «робити висновок про умови повного г≥дрол≥зу солей.
онтрольн≥ питанн€.
1. ўо називаЇтьс€ йонним добутком води? „ому воно дор≥внюЇ при 250—? як математично повТ€зан≥ рЌ ≥ концентрац≥€ йон≥в г≥дрогену у розчин≥?
2. онцентрац≥€ йон≥в г≥дрогену у розчин≥ дор≥внюЇ 10-3 моль/л. ¬изначити рЌ ≥ рќЌ цього розчину.
3. як≥ з перерахованих солей будуть п≥ддаватись г≥дрол≥зу: FeCl3, Na2SO4, K2S, Zn(NO3)2, Na3PO4? —класти молекул€рн≥ та йонн≥ р≥вн€нн€ г≥дрол≥зу, вказати рЌ ≥ середовище.
4. ѕри зливанн≥ розчин≥в кал≥й карбонату K2CO3 ≥ хром(≤≤≤) н≥трату Cr(NO3)3 утворюЇтьс€ осад хром(III) г≥дроксиду ≥ вид≥л€Їтьс€ газ. ѕо€снити це €вище. —класти молекул€рне р≥вн€нн€ сум≥сного г≥дрол≥зу двох солей.
5. ќбчислити концентрац≥ю ≥он≥в Ќ+ ≥ рЌ розчину, €кщо концентрац≥€ йон≥в ќЌ- дор≥внюЇ 10-8 моль/л.
Ћабораторна робота є 9
омплексн≥ сполуки
ќсновн≥ теоретичн≥ питанн€.
¬изначенн€ комплексних сполук, њх будова. ѕон€тт€ комплексоутворювача та л≥ганда, координац≥йного числа. ласиф≥кац≥€ комплексних сполук. ƒисоц≥ац≥€ в водних розчинах, ст≥йк≥сть. ¬≥дм≥нн≥сть комплексних та подв≥йних солей.
ћета роботи: ознайомитись з властивост€ми комплексних сполук та подв≥йних солей, способами отриманн€ комплекс≥в р≥зного типу, вивченн€ дисоц≥ац≥њ комплексних сполук.
ќбладнанн€ ≥ реактиви: штатив з проб≥рками, розчини NH4OH, NaOH, KSCN (0,01н); CuSO4 (0,5н); AgNO3 (0,1н); NaCl (нас.); ¬≥(NO3)3 (0,5н); KI (0,1н); BaCl2 (0,5н); CoCl2 (0,5н); с≥ль ћора (NH4)2Fe(SO4)2∙6H2O або FeSO4 (0,5н); FeCl3 (0,5н); K3[Fe(CN)6] (0,5н)
’≥д роботи
ƒосл≥д 1. ќдержанн€ кат≥онних комплексних солей.
а) ќдержанн€ диамм≥ноаргентум(≤) хлориду [Ag(NH3)2]Cl. ƒо розчину аргентум н≥трату додати розчин натр≥й хлориду до повного осадженн€ јg—l. ƒо утвореного осаду долити водний розчин ам≥аку до розчиненн€ осаду. «аписати р≥вн€нн€ реакц≥й утворенн€ ≥ розчиненн€ аргентум хлориду. ¬казати комплексоутворювач, його координац≥йне число, л≥ганди.
|
|
|
б) ќдержанн€ тетрамм≥нокупрум(≤≤) сульфату [—u(NH3)4]SO4. Ќалити у проб≥рку розчин купрум сульфату, в≥дм≥тити його кол≥р. ƒодавати краплинами розчин ам≥аку до утворенн€ зеленкуватого осаду г≥дроксокупрум сульфату.
ƒолити надлишок ам≥аку до повного розчиненн€ осаду ≥ утворенн€ розчину темно-синього кольору Ц комплексноњ сполуки купруму. —класти р≥вн€нн€ вс≥х реакц≥й, записати спостереженн€.
ƒосл≥д 2. ќдержанн€ ан≥онних комплексних солей.
а ) ал≥й тетрайодоб≥смутат(≤≤≤) K[BiI4].
” проб≥рку налити 0,5 мл розчину в≥смут (≤≤≤) н≥трату ≥ додати розчин кал≥й йодиду до утворенн€ темно-бурого осаду BiI3 ≥ його повного подальшого розчиненн€ з утворенн€м комплексу жовтого кольору.
—класти р≥вн€нн€ реакц≥й. «аписати спостереженн€.
б) Ќатр≥й гексаг≥дроксохромат(≤≤≤) Na3[Cr(OH)6] (г≥дроксокомплекс).
” проб≥рку налити розчин сол≥ хрому(≤≤≤) ≥ додати по крапл€х розчин натр≥й г≥дроксиду до утворенн€ ≥ розчиненн€ осаду.
—класти р≥вн€нн€ реакц≥й, €к≥ в≥дбуваютьс€ в проб≥рц≥ (утворенн€ основних солей, г≥дроксиду, комплексноњ сполуки). ¬казати комплексоутворювач, л≥ганд, координац≥йне число та зар€д комплексного йону.
ƒосл≥д 3. ѕодв≥йн≥ ≥ комплексн≥ сол≥.
ƒл€ досл≥дженн€ вз€ти розчини двох солей: подв≥йну - зал≥зоамон≥йний галун NH4Fe(SO4)2 ≥ комплексну Ц кал≥й гексац≥аноферат(≤≤≤) K3[Fe(CN)6], €к≥ м≥ст€ть ≥он Fe3+. «аписати р≥вн€нн€ њх дисоц≥ац≥њ ≥ визначити за допомогою €к≥сних реакц≥й, €к≥ йони ≥снують у цих розчинах.
а) ƒосл≥дженн€ галуну. ” три проб≥рки налити по 1 мл розчину галуну. ” першу проб≥рку додати розчин кал≥й родан≥ду KCNS, у другу Ц розчин бар≥й хлориду ¬а—12 , у третю Ц розчин натр≥й г≥дроксиду NaOH (п≥д≥гр≥ти цю проб≥рку ≥ обережно понюхати). —класти р≥вн€нн€ реакц≥й, €к≥ в≥дбуваютьс€ у кожн≥й проб≥рц≥. «аписати спостереженн€.
б) ƒосл≥дженн€ комплексноњ сполуки. ” дв≥ проб≥рки налити по 1 мл розчину комплексноњ сол≥. ” першу додати розчин кал≥й родан≥ду, у другу Ц натр≥й г≥дроксиду. «аписати, €к≥ зм≥ни в≥дбуваютьс€ у проб≥рках. ¬≥дм≥тити, €к≥ йони присутн≥ у розчин≥. «робити висновок про природу подв≥йних ≥ комплексних солей.
онтрольн≥ питанн€:
1. «аписати у вигл€д≥ комплексних солей наступн≥ сполуки: 2KCl∙PtCl4; AlF3∙3NaF; 3KNO2∙Co(NO2)3. ¬казати комплексоутворювач ≥ л≥ганди.
2. ¬изначити зар€ди ≥ тип комплексних ≥он≥в: [Cu(NH3)4]x, [CrCl6]x, [Cr(H2O)3Cl3]x.
3. ѕорахувати, €кий ступ≥нь окисненн€ маЇ комплексоутворювач у сполуках: [Pt(NH3)5Br](NO3)3; [Pt(NH3)2Cl2]; K4[Fe(CN)6].
4. Ќаписати р≥вн€нн€ дисоц≥ац≥њ та вираз константи нест≥йкост≥ дл€ сполук: а) K2[HgI4], б) [Co(NH3)5Cl]Cl2.
5. «ак≥нчити р≥вн€нн€ утворенн€ комплексних сполук, вказати комплексоутворювач, його координац≥йне число, л≥ганди:
а) 3KCN + Cr(CN)3 =; б) CuCl2 + 2HCl =; в) CoCl3 + 4NH3 + H2O =.






