ћ≥н≥стерство осв≥ти ≥ науки ”крањни
ињвський нац≥ональний ун≥верситет технолог≥й та дизайну
’≤ћ≤я
Ћабораторний практикум
дл€ студент≥в технолог≥чних спец≥альностей
напр€му 0516 Ђ“екстильна та легка промислов≥стьї
денноњ форми навчанн€
„астина ≤.
ињв 2012
’≤ћ≤я: лабораторний практикум дл€ студент≥в технолог≥чних спец≥альностей напр€му 0516 Ђ“екстильна та легка промислов≥стьї денноњ форми навчанн€. „астина ≤. / ”пор.: ќ. ¬. ислова, ќ. ќ. Ѕутенко. - .: Ќ”“ƒ, 2012. Ц 23 с. ”кр.мовою
”пор€дники: ќ. ¬. ислова, канд. б≥ол. наук, доцент
ќ. ќ. Ѕутенко, асистент
¬≥дпов≥дальний за випуск: зав≥дувач кафедри електрох≥м≥чноњ енергетики та х≥м≥њ д.х.н., професор ¬. «. Ѕарсуков.
«атверджено на зас≥данн≥ кафедри електрох≥м≥чноњ енергетики та х≥м≥њ. ѕротокол є10 в≥д 16.05.2012 р.
рекомендованј л≥тературј
1. ¬.¬. √ригорТЇва, ¬.ћ. —ам≥йленко, ј.ћ. —ич, ќ.ј.√олуб. «агальна х≥м≥€: ѕ≥друч. дл€ студ. нех≥м. спец. вищ. навч. заклад≥в. Ц .: ¬ища шк., 2009. Ц 471 с.
2.ћуст€ца ќ.Ќ., янкович ¬.ћ. «агальна х≥м≥€. - ., јр≥стей, 2007. - 275 с.
3.–ейтер Ћ.√., —тепаненко ќ.ћ., Ѕасов ¬.ѕ. “еоретичн≥ розд≥ли загальноњ х≥м≥њ. ., аравела, 2006. - 304 с.
4.–оманова Ќ.¬. «агальна та неорган≥чна х≥м≥€. .. ѕерун,1998. - 480с.
5.Ћуцевич ƒ.ƒ., Ѕерезан ќ.¬. онспект-дов≥дник з х≥м≥њ. Ц .: ¬ища шк., 1997. Ц 240 с.
«агальн≥ методичн≥ вказ≥вки
ƒисципл≥на У’≥м≥€Ф Ї одн≥Їю з фундаментальних природознавчих наук, €ка надаЇ студентам у€вленн€ про загальн≥ законом≥рност≥ х≥м≥чних процес≥в та €вищ, що в≥дбуваютьс€ в навколишньому св≥т≥, спри€Ї розвитку х≥м≥чного та еколог≥чного мисленн€, прищеплюЇ певн≥ навички проведенн€ х≥м≥чного експерименту.
ћетодичн≥ вказ≥вки Ї практичним пос≥бником до лабораторних зан€ть з х≥м≥њ дл€ студент≥в-бакалавр≥в технолог≥чних спец≥альностей ≥ в≥дпов≥дають навчальн≥й програм≥ з дисципл≥ни Ђ’≥м≥€ї.
ћета
даного виданн€ Ц закр≥пити на практиц≥ теоретичний програмний матер≥ал, оволод≥ти навичками роботи в лаборатор≥њ дл€ подальшоњ фаховоњ д≥€льност≥.
ƒл€ виконанн€ лабораторних роб≥т студент повинен знати:
- правила техн≥ки безпеки при робот≥ в х≥м≥чн≥й лаборатор≥њ;
- основн≥ теоретичн≥ положенн€ курсу;
- загальн≥ властивост≥ х≥м≥чних елемент≥в ≥ сполук;
- законом≥рност≥ прот≥канн€ х≥м≥чних перетворень ≥ њх застосуванн€ у виробництв≥.
ѕ≥сл€ виконанн€ лабораторного практикуму студент повинен вм≥ти:
- проводити х≥м≥чний експеримент з використанн€м х≥м≥чного обладнанн€ ≥ реактив≥в;
- анал≥зувати своњ спостереженн€ за проходженн€м х≥м≥чних перетворень, узагальнювати њх ≥ систематизувати одержан≥ результати;
- застосовувати набут≥ знанн€ при вивченн≥ спец≥альних дисципл≥н, в подальш≥й профес≥йн≥й д≥€льност≥.
Ћабораторн≥ роботи повТ€зан≥ з використанн€м х≥м≥чного посуду та реактив≥в, €к≥ можуть бути небезпечними при невм≥лому користуванн≥. “ому необх≥дно виконувати вс≥ вимоги ≥ правила техн≥ки безпеки при робот≥ у х≥м≥чн≥й лаборатор≥њ, ч≥тко витримувати пор€док ≥ посл≥довн≥сть операц≥й.
|
|
|
ѕротокол лабораторноњ роботи повинен м≥стити:
-номер роботи та њњ назву, мету;
-номер ≥ назву досл≥ду, скорочений запис ходу роботи з вказ≥вкою умов проведенн€ досл≥ду;
-малюнки ≥ схеми прилад≥в;
-р≥вн€нн€ реакц≥й, необх≥дн≥ розрахунки, граф≥ки;
-висновки.
¬с≥ спостереженн€ у лабораторному зошит≥ необх≥дно робити п≥сл€ зак≥нченн€ досл≥ду.
¬ к≥нц≥ кожноњ роботи наведен≥ контрольн≥ завданн€, виконанн€ €ких дозволить перев≥рити р≥вень засвоЇнн€ та розум≥нн€ теоретичного програмного матер≥алу та п≥дготуватись до захисту лабораторноњ роботи.
¬еденн€ протоколу перев≥р€Ї ≥ п≥дписуЇ викладач.
ѕ≥сл€ виконанн€ вс≥х лабораторних роб≥т та њх захисту студент допускаЇтьс€ до зал≥ку та екзамену.
Ћабораторна робота є1
“ехн≥ка безпеки при робот≥ у х≥м≥чн≥й лаборатор≥њ. ћетоди вид≥ленн€ ≥ очищенн€ речовин.
ќсновн≥ теоретичн≥ питанн€.
ѕравила поводженн€ в х≥м≥чн≥й лаборатор≥њ, пон€тт€ речовини, класиф≥кац≥€ речовин за ступенем чистоти, методи очищенн€ твердих та р≥дких речовин, основний х≥м≥чний посуд (назви та призначенн€).
ћета роботи: ознайомити студент≥в з основними правилами техн≥ки безпеки при робот≥ у х≥м≥чн≥й лаборатор≥њ; навчити орган≥зац≥њ прац≥ ≥ робочого м≥сц€ дл€ наступних роб≥т; засвоњти основн≥ прийоми лабораторного експерименту.
ќбладнанн€ та реактиви: х≥м≥чний посуд; штатив з набором реактив≥в; техн≥чн≥ ваги ≥ р≥вноваги до них; ф≥льтрувальний пап≥р (ф≥льтри), х≥м≥чн≥ скл€нки р≥зноњ Їмност≥, скл€н≥ палички, штатив з к≥льцем.
’≥д роботи
ƒосл≥д 1. ‘≥льтруванн€.
¬ х≥м≥чну скл€нку або колбу налити води, €ка м≥стить механ≥чн≥ дом≥шки (п≥сок) та розчинен≥ сол≥ (наприклад, NaCl), приготувати складчастий паперовий ф≥льтр ≥ пом≥стити його у л≥йку, закр≥плену у к≥льц≥ штативу. ѕ  ≥д л≥йку поставити другу х≥м≥чну скл€нку так, щоб вит€гнутий к≥нець л≥йки торкавс€ ст≥нки скл€нки ≥ р≥дина при ф≥льтруванн≥ не розбризкувалась, а ст≥кала по ст≥нц≥. ¬оду в л≥йку необх≥дно наливати на 2-3 мм нижче крањв ф≥льтру, обережно, за допомогою скл€ноњ палички, €ку тримати над л≥йкою п≥д кутом.
≥д л≥йку поставити другу х≥м≥чну скл€нку так, щоб вит€гнутий к≥нець л≥йки торкавс€ ст≥нки скл€нки ≥ р≥дина при ф≥льтруванн≥ не розбризкувалась, а ст≥кала по ст≥нц≥. ¬оду в л≥йку необх≥дно наливати на 2-3 мм нижче крањв ф≥льтру, обережно, за допомогою скл€ноњ палички, €ку тримати над л≥йкою п≥д кутом.
якщо на дн≥ скл€нки залишивс€ нерозчинний осад, необх≥дно перенести його на ф≥льтр, додавши трохи води та збовтавши.
«аписати спостереженн€. Ќамалювати прилад.
ƒосл≥д 2. ¬озгонка (субл≥мац≥€).

 ќдержати у лаборанта кристал≥чний йод та пом≥стити його у порцел€нову чашку. «акр≥пити њњ в штатив≥ над пальником, а зверху над нею розм≥стити скл€ну л≥йку або колбу з водою. «а допомогою газового пальника обережно, на маленькому полумТњ, нагр≥вати чашку, сл≥дкуючи, щоб пари йоду не виходили назовн≥, а охолоджуючись, ос≥дали на ст≥нках л≥йки або дн≥ колби.
ќдержати у лаборанта кристал≥чний йод та пом≥стити його у порцел€нову чашку. «акр≥пити њњ в штатив≥ над пальником, а зверху над нею розм≥стити скл€ну л≥йку або колбу з водою. «а допомогою газового пальника обережно, на маленькому полумТњ, нагр≥вати чашку, сл≥дкуючи, щоб пари йоду не виходили назовн≥, а охолоджуючись, ос≥дали на ст≥нках л≥йки або дн≥ колби.
ѕо зак≥нченн≥ охолодити прилад, обережно шматочком ф≥льтрувального паперу перенести йод з колби у чистий бюкс з притертою кришкою. «аписати спостереженн€. ¬озгонкою очищають також кристал≥чний амон≥й хлорид, бензойну кислоту.
ƒосл≥д 3. ѕерегонка (дистил€ц≥€)
ѕроста перегонка при атмосферному тиску доц≥льна дл€ очищенн€ р≥дин в≥д нелетких або важколетких речовин. Ќа рисунку наведено прилад дл€ дистил€ц≥њ води, €кий складаЇтьс€ з колби (1), холодильника Ћ≥б≥ха (2), форштоса (3), алонжа (4) та приймача (5).  «≥брати прилад дл€ перегонки, €к показано на рисунку. ѕровести перегонку розчину етилового спирту.
«≥брати прилад дл€ перегонки, €к показано на рисунку. ѕровести перегонку розчину етилового спирту.
ƒосл≥д 4. ѕерекристал≥зац≥€
Ќеобх≥дно приготувати насичений розчин м≥дного купоросу. ƒл€ цього до х≥м≥чноњ скл€нки внести невелику к≥льк≥сть сол≥ —uSO4∙H2O. ƒодати 25-30 мл води ≥ розчинити с≥ль при нагр≥ванн≥. ќхолодити розчин. —постер≥гати, €к частина розчиненоњ сол≥ випадаЇ в осад. ”творен≥ чист≥ кристали в≥докремити в≥д розчину ф≥льтруванн€м, висушити та пор≥вн€ти њх за кольором з вих≥дною забрудненою с≥ллю. «робити висновки.
|
|
|
ƒосл≥д 5. Ћабораторний посуд
Ќайчаст≥ше в лабораторн≥й практиц≥ дл€ проведенн€ х≥м≥чних реакц≥й, приготуванн€ ≥ збер≥ганн€ розчин≥в використовуЇтьс€ наступний посуд (рис.1): скл€н≥ проб≥рки (1); х≥м≥чн≥ скл€нки (2); колби круглодонн≥ (3), плоскодонн≥ (4), ¬юрца (5), кон≥чн≥ (6, 7); реторти (8) та колби дл€ промиванн€ (10). ƒл€ перекристал≥зац≥њ речовин використовують кристал≥затор (9).
 | |||
 | |||

1 2 3 4 5
 | |||
 | |||
6 7 8 9 10
рис.1
« метою запоб≥ганн€ поглинанн€ речовинами вологи з пов≥тр€ њх збер≥гають в ексикатор≥ (рис. 2 а), €кий заповнений сухим пов≥тр€м та водопоглинаючими речовинами ≥ застосовуЇтьс€ дл€ пов≥льного висушуванн€ та збереженн€ речовин, що легко поглинають вологу пов≥тр€.



 як водопоглинаюч≥ речовини в ексикаторах застосовуютьс€ прожарений кальц≥й хлорид або концентрована сульфатна кислота.
як водопоглинаюч≥ речовини в ексикаторах застосовуютьс€ прожарений кальц≥й хлорид або концентрована сульфатна кислота.
√ар€ч≥ предмети перенос€ть з одного м≥сц€ на ≥нше за допомогою порцел€новоњ п≥дставки (б), п≥нцет≥в (в) або тигельних щипц≥в (г, д) (рис. 2).
ƒл€ закр≥пленн€ посуду п≥д час роботи застосовують зал≥зн≥ штативи з затискачами (1) та к≥льц€ми (2) (рис. 3). якщо треба прогр≥ти проб≥рку нетривалий час, то њњ можна не закр≥пл€ти на штатив≥, а тримати в руц≥ за допомогою тримача дл€ проб≥рок.
ѕри проведенн≥ х≥м≥чних досл≥д≥в часто доводитьс€ розчин€ти речовини, ф≥льтрувати р≥дини, промивати осади та визначати густину розчин≥в ареометром.


 ƒл€ подр≥бненн€ кристал≥чних речовин перед розчиненн€м до порошкопод≥бного стану використовують скл€н≥ (рис. 4, а), порцел€нов≥ (рис. 4, б), агатов≥ (рис. 4, в) та металев≥ (рис. 4, г) ступки.
ƒл€ подр≥бненн€ кристал≥чних речовин перед розчиненн€м до порошкопод≥бного стану використовують скл€н≥ (рис. 4, а), порцел€нов≥ (рис. 4, б), агатов≥ (рис. 4, в) та металев≥ (рис. 4, г) ступки.
ѕри випарюванн≥ р≥дин найчаст≥ше застосовуютьс€ порцел€нов≥ чашки.

|
ƒл€ вим≥рюванн€ об¢Їму р≥дини використовують м≥рний посуд: колби, цил≥ндри (рис.4, д), мензурки (рис.4, е). ћ≥рними колбами (рис.5, а) користуютьс€ в тих випадках, коли необх≥дно одержати певний об¢Їм р≥дини. ÷≥ колби можуть бути р≥зноњ м≥сткост≥: в≥д 25 мл до 2 л включно.


ƒл€ точного вим≥рюванн€ об¢Їму р≥дини також використовують титрувальн≥ бюретки (рис.5, б) та п≥петки (рис.5, в) м≥стк≥стю в≥д 1 до 100 мл. ƒл€ ф≥льтруванн€ осад≥в застосовують скл€н≥ л≥йки (рис. 5, г).
ƒл€ дозуванн€ р≥дин користуютьс€ крапельними л≥йками (рис.5, д), а дл€ розд≥ленн€ р≥дин, що не зм≥шуютьс€, Ц д≥лильними л≥йками (рис.5, е).
ожний розчин певноњ густини маЇ в≥дпов≥дну концентрац≥ю. ƒл€ визначенн€ концентрац≥њ розчину за його в≥дносною густиною користуютьс€ ареометром (рис.5, к). јреометром можна визначати густину розчину швидко, але досить приблизно. “ому дл€ точного визначенн€ густини розчину застосовують п≥кнометри (рис. 5, ж).
онтрольн≥ питанн€.
1. ѕо€снити, €к≥ правила з техн≥ки безпеки необх≥дно виконувати у х≥м≥чн≥й лаборатор≥њ. „и можна брати дл€ досл≥д≥в будь-€кий посуд ≥ реактиви з на€вних у лаборатор≥њ?
2. яку к≥льк≥сть реактив≥в необх≥дно брати дл€ досл≥д≥в? „и можна р≥зн≥ реактиви в≥дм≥р€ти одним цил≥ндром, не помивши його?
3. як необх≥дно нюхати вм≥ст проб≥рок?
4. як провести нагр≥ванн€ проб≥рок з р≥диною у полумТњ пальника?
5. ўо таке ваги та зважуванн€? як вз€ти наважку речовини на техно-х≥м≥чних вагах?
Ћабораторна робота є2
(≥ндив≥дуальна експериментально-розрахункова робота)
¬изначенн€ мол€рноњ маси карбон (IV) оксиду
(вуглекислого газу)
ќсновн≥ теоретичн≥ питанн€.
’≥м≥чн≥ пон€тт€ (х≥м≥чний елемент, речовина, атомна та мол€рна маса, мол€рний обТЇм газу, моль речовини, в≥дносна густина одного газу за ≥ншим) та основн≥ закони х≥м≥њ (збереженн€ маси ≥ енерг≥њ, пост≥йного складу, јвогадро та три насл≥дки з нього, обТЇднаний газовий закон, р≥вн€нн€ лапейрона-ћенделЇЇва). ѓх формулюванн€ та математичн≥ формули дл€ розрахунк≥в.
|
|
|
ћета роботи: ознайомитись з одним з метод≥в визначенн€ мол€рноњ маси речовин в газопод≥бному стан≥ та навчитись розраховувати мол€рну масу газ≥в за отриманими експериментальними даними р≥зними способами.
ќбладнанн€ ≥ реактиви: техно-х≥м≥чн≥ваги ≥ р≥зноваги; м≥рний цил≥ндр на 250 мл; прилад дл€ одержанн€ газу або подушка з газом; колба на 250 мл з корком дл€ зважуванн€; термометр, барометр.
’≥д роботи
ƒл€ експериментального визначенн€ мол€рноњ маси вуглекислого газу беруть суху чисту колбу, закриту корком до позначки на горл≥. «важують колбу з пробкою на техно-х≥м≥чних терезах з точн≥стю до 0,005 г ≥ записують масу колби з пов≥тр€м.
ѕрот€гом 4-5 хв заповнюють колбу карбон (≤V) оксидом. ѕов≥льно вит€гують газов≥дв≥дну трубку з колби ≥ швидко закривають њњ корком у вертикальному положенн≥. «важують колбу з газом ≥ записують масу колби з карбон (≤V) оксидом.
ўоб визначити обТЇм колби, необх≥дно заповнити њњ водою до позначки на горл≥, ≥ вим≥р€ти обТЇм води м≥рним цил≥ндром.
‘≥ксують температуру ≥ тиск в умовах проведенн€ експерименту.
–озрахункова частина
¬с≥ необх≥дн≥ дл€ розрахунк≥в експериментальн≥ дан≥ по вар≥антах наведено в таблиц≥ 2.1. Ќомер вар≥анту в≥дпов≥даЇ пор€дковому номеру студента у списку.
“аблиц€ 2.1
| є п/п | –, кѕа | T, о— |  ,г ,г
|  ,г ,г
| V колби, л |
| 100,1 | 125,340 | 125,520 | 0,1 | ||
| 99,5 | 169,720 | 171,945 | 0,127 | ||
| 100,7 | 144,950 | 145,150 | 0,110 | ||
| 102,9 | 137,125 | 137,315 | 0,102 | ||
| 98,9 | 158,340 | 158,510 | 0,096 | ||
| 100,3 | 140,860 | 141,070 | 0,118 | ||
| 99,1 | 164,285 | 164,515 | 0,129 | ||
| 101,8 | 139,790 | 139,975 | 0.103 | ||
| 100,5 | 148,040 | 148,285 | 0,135 | ||
| 99,4 | 161,300 | 161,490 | 0,106 | ||
| 100,6 | 153,760 | 153,975 | 0,120 | ||
| 98,8 | 136,135 | 136,305 | 0,097 | ||
| 101,6 | 145,840 | 146,055 | 0,115 | ||
| 99,2 | 129,200 | 129,365 | 0,093 | ||
| 102,1 | 133,960 | 134,155 | 0,105 |
¬икористовуючи дан≥ свого вар≥анту, обчислюють:
1) обТЇм газу в колб≥ за нормальних умов (н.у.) за допомогою р≥вн€нн€ обТЇднаного газового закону –V/“ =–0V0/“0
 ,
,
де “ = 273 + t 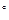 —, –0 = 101,3 кѕа, “0 = 273
—, –0 = 101,3 кѕа, “0 = 273
2) масу пов≥тр€ в обТЇм≥ колби (н.у.), знаючи, що маса 1 л пов≥тр€ за н.у. дор≥внюЇ 1,293 г:

3) масу порожньоњ колби без газ≥в €к р≥зницю м≥ж масою колби з пов≥тр€м ≥ масою пов≥тр€ в обТЇм≥ колби:
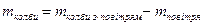
4) масу карбон (≤V) оксиду в обТЇм≥ колби €к р≥зницю м≥ж масою колби з вуглекислим газом ≥ масою порожньоњ колби:

ќбчислюють мол€рну масу —ќ2 трьома способами, €к≥ наведен≥ нижче.
≤. «а законом јвогадро з використанн€м мол€рного обТЇму газу
(Vm=22,4 л/моль за н.у.):
 =
= 
≤≤. «а в≥дносною густиною D. ƒл€ однакових обТЇм≥в газ≥в за н.у.
Dпов =  / mпов . = ћ
/ mпов . = ћ 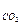 / ћпов≥тр€
/ ћпов≥тр€
ќск≥льки ћпов≥тр€ = 28,98 г/моль, тод≥
 =
= 
≤≤≤. «а р≥вн€нн€м лапейрона-ћенделЇЇва: –V=  R“/ћх, де m- маса —ќ2 у колб≥, г; R = 8,314 ƒж/(моль∙ ); “- температура досл≥ду, ; –- тиск, кѕа; V- обТЇм —ќ2 у колб≥ на початку досл≥ду, л (за табличними даними).
R“/ћх, де m- маса —ќ2 у колб≥, г; R = 8,314 ƒж/(моль∙ ); “- температура досл≥ду, ; –- тиск, кѕа; V- обТЇм —ќ2 у колб≥ на початку досл≥ду, л (за табличними даними).
 =
= 
¬изначити абсолютну ≥ в≥дносну похибки досл≥ду. јбсолютна похибка Ї р≥зницею м≥ж теоретичним ≥ середн≥м експериментально розрахованим значенн€ми мол€рноњ маси —ќ2:
|
|
|
јбсолютна похибкa =| ћтеор.- ћдосл . |
¬≥дносна похибка Ц це в≥дношенн€ абсолютноњ похибки до теоретичного значенн€ ћсо2 ≥ обчислюЇтьс€ у в≥дсотках:
¬≥дносна похибка 
 %
%
«робити висновок про результат роботи.
онтрольн≥ питанн€.
1. ќбчислити масу 5 л кисню за н.у. —к≥льки молекул м≥стить цей обТЇм газу? якою Ї маса одн≥Їњ молекули ќ2 в грамах?
2. ќбчислити мол€рну масу газу, €кщо 1 мл його за н.у. важить 1,96 мг.
3. ¬изначити, €ка к≥льк≥сть моль м≥ститьс€ у: а) 104,2 г бар≥й хлориду; б) 4,6 г натр≥ю; в) 56 л азоту.
4. ѕри €кому тиску (ѕа) маса хлору обТЇмом 3 л дор≥внюЇ 2,5 г, €кщо температура становить 23∞—? R= 8,314 ѕа∙м3/ ∙моль.
5. √устина нев≥домого газу за воднем (Ќ2) дор≥внюЇ 2,562. ¬изначити масу 5 л цього газу за н.у.
Ћабораторна робота є3
(≥ндив≥дуальна експериментально-розрахункова робота)
¬изначенн€ мол€рноњ маси екв≥валенту металу
ќсновн≥ теоретичн≥ питанн€.
¬изначенн€ та формули дл€ обчисленн€ мол€рних мас екв≥валент≥в простих та складних речовин р≥зних клас≥в; екв≥валентний обТЇм газопод≥бних речовин; формулюванн€ та математичний вираз закону екв≥валент≥в.
ћета роботи: ознайомитись з методом визначенн€ мол€рноњ маси екв≥валенту металу за обТЇмом водню, що витискаЇтьс€ металом при взаЇмод≥њ з кислотами - неокисниками.
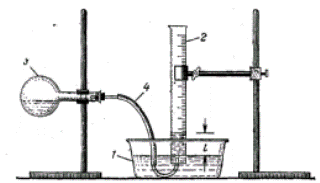 ќбладнанн€ ≥ реактиви: прилад дл€ визначенн€ екв≥валенту металу (див. рис.); наважку металу; розчин хлоридноњ кислоти (2 н); термометр, барометр.
ќбладнанн€ ≥ реактиви: прилад дл€ визначенн€ екв≥валенту металу (див. рис.); наважку металу; розчин хлоридноњ кислоти (2 н); термометр, барометр.
’≥д роботи
¬ основ≥ методу визначенн€ екв≥валентноњ маси металу лежить реакц≥€ взаЇмод≥њ метал≥в, €к≥ розташован≥ в електрох≥м≥чному р€д≥ напруг метал≥в до √≥дрогену, з кислотами-неокисниками:
ће + nЌ—≤ = ће—≤n +  Ќ2↑, n-валентн≥сть металу.
Ќ2↑, n-валентн≥сть металу.
ƒл€ роботи необх≥дно вз€ти порошок металу (магн≥ю, алюм≥н≥ю, цинку ≥ т.д.).
¬ колбу Їмк≥стю 100 мл (3) налити 10 мл розведеноњ хлоридноњ кислоти ≥ закр≥пити њњ в штатив≥.
¬ м≥рний цил≥ндр (2) налити воду, закрити скл€ною пластиною так, щоб не було пухирц≥в пов≥тр€, перевернути догори дном та опустити його отвором в кристал≥затор з водою (1). «н€ти п≥д водою скл€ну пластину. ÷ил≥ндр закр≥пити вертикально. ¬ горло колби (3) покласти наважку металу  , щ≥льно закрити пробкою з газов≥дв≥дною трубкою (4). ≥нець трубки ввести в отв≥р цил≥ндра. ѕеревести колбу (3) у вертикальне положенн€, щоб метал впав у кислоту. ¬ ход≥ реакц≥њ водень, що утворюЇтьс€, надходить у цил≥ндр ≥ витискаЇ з нього воду. ѕ≥сл€ зак≥нченн€ реакц≥њ необх≥дно визначити в цил≥ндр≥ обТЇм утвореного газу,
, щ≥льно закрити пробкою з газов≥дв≥дною трубкою (4). ≥нець трубки ввести в отв≥р цил≥ндра. ѕеревести колбу (3) у вертикальне положенн€, щоб метал впав у кислоту. ¬ ход≥ реакц≥њ водень, що утворюЇтьс€, надходить у цил≥ндр ≥ витискаЇ з нього воду. ѕ≥сл€ зак≥нченн€ реакц≥њ необх≥дно визначити в цил≥ндр≥ обТЇм утвореного газу,  , висоту стовпчика води в цил≥ндр≥ в≥д поверхн≥ води в кристал≥затор≥, h(мм), записати показники барометра Ц
, висоту стовпчика води в цил≥ндр≥ в≥д поверхн≥ води в кристал≥затор≥, h(мм), записати показники барометра Ц  (кѕа) та термометра Ц tдосл.(
(кѕа) та термометра Ц tдосл.( ).
).
–озрахункова частина
¬с≥ необх≥дн≥ дл€ розрахунк≥в експериментальн≥ дан≥ по вар≥антах наведено в таблиц≥ 3.1. Ќомер вар≥анту в≥дпов≥даЇ пор€дковому номеру студента у списку. ¬иконавши потр≥бн≥ розрахунки, студент маЇ визначити екв≥валентну масу ≥ назву металу.
“аблиц€ 3.1
| є п/п |  (кѕа) (кѕа)
| tдосл.( ) )
| h(мм) | 
| 
| ¬алентн≥сть |
| 99,2 | 92,5 | ≤≤ | ||||
| 98,7 | ≤ | |||||
| 101,6 | 38,5 | ≤≤ | ||||
| 102,3 | ≤≤ | |||||
| 99,5 | ≤≤ | |||||
| 98,3 | ≤ | |||||
| 100,5 | ≤≤≤ | |||||
| 102,4 | ≤≤ | |||||
| 99,8 | ≤≤ | |||||
| 98,9 | ≤≤ | |||||
| 100,1 | ≤ | |||||
| 100,7 | ≤≤ | |||||
| 98,6 | ≤≤ | |||||
| 102,1 | ≤≤ | |||||
| 101,8 | ≤≤ |
ћол€рну масу екв≥валента металу за законом екв≥валент≥в розраховуЇмо двома способами:
1. „ерез масу вид≥леного водню.
«астосовуючи р≥вн€нн€ стану ≥деального газу лапейрона - ћенделЇЇва 
 ,
,
визначити масу водню  , €кий вид≥ливс€ в ход≥ х≥м≥чноњ реакц≥њ.
, €кий вид≥ливс€ в ход≥ х≥м≥чноњ реакц≥њ.
“иск водню в цил≥ндр≥ ( ) визначити ≥з сп≥вв≥дношенн€:
) визначити ≥з сп≥вв≥дношенн€:
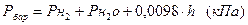 ,
,
де  - тиск насиченоњ вод€ноњ пари (кѕа) при температур≥ досл≥ду (табл. 3.2),
- тиск насиченоњ вод€ноњ пари (кѕа) при температур≥ досл≥ду (табл. 3.2),
h Ц висота стовпчика води в цил≥ндр≥ в≥д поверхн≥ води в кристал≥затор≥, мм.
“аблиц€ 3.2






