“емпература, 
| “иск, кѕа | “емпература, 
| “иск, кѕа |
| 1,597 | 2,189 | ||
| 1,705 | 2,337 | ||
| 1,817 | 2,486 | ||
| 1,935 | 2,642 | ||
| 2,062 | 2,841 |
“емпература пов≥тр€ в прим≥щенн≥ дор≥внюЇ “ = 273 + t0—.
¬икористовуючи закону екв≥валент≥в  , визначити екв≥валентну масу металу, враховуючи, що
, визначити екв≥валентну масу металу, враховуючи, що 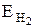 = 1 г/моль.
= 1 г/моль.
2. „ерез обТЇм вид≥леного водню, приведений до нормальних умов.
«астосовуючи р≥вн€нн€ обТЇднаного газового закону 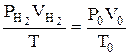 привести обТЇм вид≥леного водню до нормальних умов (V0).
привести обТЇм вид≥леного водню до нормальних умов (V0).
«найти екв≥валентну масу металу за формулою:

де  - наважка металу (г);
- наважка металу (г);
 - екв≥валентний обТЇм водню (дор≥внюЇ 11200 мл/моль за н. у.).
- екв≥валентний обТЇм водню (дор≥внюЇ 11200 мл/моль за н. у.).
ќбчислити середню екв≥валентну масу металу.
–озрахувати атомну масу металу через сп≥вв≥дношенн€ екв≥валентноњ маси металу ≥ валентност≥ (¬):
ј = ≈ће∙¬
¬икористовуючи пер≥одичну таблицю елемент≥в ƒ.≤.ћенделЇЇва, визначити назву металу. «робити висновок.
онтрольн≥ питанн€.
1. ¬изначити екв≥валентн≥ маси наступних речовин: N2O5;H3PO4; ¬а(ќЌ)2; Ca3(PO4)2; FeCl3; MgHPO4; AlOH(NO3)2.
2. ѕри розчиненн≥ у кислот≥ 3,06 г металу вид≥лилос€ 2,8 л водню за н.у. ¬изначити мол€рну масу екв≥валенту металу.
3. ¬изначити атомну масу двовалентного металу, €кщо дл€ окисненн€ 8,34 г металу використано 0,680 л кисню (н.у.).
4. ѕри нагр≥ванн≥ 0,92 г олова у кисн≥ утворилось 1,17 г оксиду. «найти валентн≥сть олова у цьому оксид≥ ≥ записати його формулу.
5. ћасова частка алюм≥н≥ю у його хлорид≥ складаЇ 20,22%. ќбчислити мол€рну масу екв≥валенту алюм≥н≥ю, валентн≥сть ≥ скласти формулу хлориду.
Ћабораторна робота є4
Ўвидк≥сть х≥м≥чних реакц≥й. ’≥м≥чна р≥вновага
ќсновн≥ теоретичн≥ питанн€.
Ўвидк≥сть реакц≥њ, фактори, в≥д €ких вона залежить; закон д≥ючих мас дл€ гомогенних ≥ гетерогенних процес≥в; ф≥зичний зм≥ст константи швидкост≥; правило ¬ант-√оффа ≥ його математичний вираз; катал≥з ≥ катал≥затори; оборотн≥ та необоротн≥ реакц≥њ, стан х≥м≥чноњ р≥вноваги у систем≥; принцип Ће-Ўателье.
ћета роботи: вивченн€ залежност≥ швидкост≥ реакц≥њ в≥д природи ≥ концентрац≥й реагуючих речовин, температури, ступен€ подр≥бненн€ твердих речовин, на€вност≥ катал≥затору.
ќбладнанн€ ≥ реактиви: гранульован≥ цинк ≥ олово; грудки ≥ порошок крейди; розчини кислот HCl, H2SO4 (2 н), розчин Na2S2O3 (0,25н); дистильована вода; проб≥рки великого обТЇму; секундом≥р.
’≥д роботи
ƒосл≥д 1. ¬плив природи реагуючих речовин на швидк≥сть реакц≥њ.
” дв≥ проб≥рки налити по 1 мл хлоридноњ кислоти. ” одну з них занурити гранулу цинку, у другу Ц гранулу олова. ѕор≥вн€ти ≥нтенсивн≥сть утворенн€ бульбашок Ќ2 в обох проб≥рках. «аписати р≥вн€нн€ реакц≥й. «робити висновок про вплив природи металу на швидк≥сть реакц≥њ.
ƒосл≥д 2. ¬плив площ≥ поверхн≥ реагент≥в на швидк≥сть реакц≥њ.
” дв≥ проб≥рки налити по 1 мл хлоридноњ кислоти. ѕриготувати маленьку грудку крейди ≥ приблизно таку ж к≥льк≥сть порошку крейди. ќдночасно внести крейду в обидв≥ проб≥рки ≥ спостер≥гати утворенн€ д≥оксиду карбону —ќ2. ѕор≥вн€ти час розчиненн€ крейди в обох проб≥рках. «аписати р≥вн€нн€ реакц≥њ. «робити висновок про вплив ступен€ подр≥бненн€ твердих речовин на швидк≥сть реакц≥њ.
|
|
|
ƒосл≥д 3. «алежн≥сть швидкост≥ реакц≥њ в≥д концентрац≥њ реагуючих речовин.
ƒл€ досл≥ду вз€ти розчин натр≥й т≥осульфату, сульфатну кислоту, дистильовану воду ≥ проб≥рки великого обТЇму (за вказ≥вкою лаборанта).
–еакц≥€ м≥ж т≥осульфатом ≥ сульфатною кислотою маЇ вигл€д:
Na2S2O3 + H2SO4 = Na2SO4 + S + SO2 + H2O,
—постер≥гаЇтьс€ поступове помутн≥нн€ розчину внасл≥док утворенн€ в≥льноњ с≥рки. Ўвидк≥сть по€ви с≥рки залежить в≥д концентрац≥њ реагент≥в ≥ може бути визначена у час≥.
” три пронумерован≥ проб≥рки за допомогою спец≥ального цил≥ндру налити розчин т≥осульфату натр≥ю: в першу Ц 5 мл, у другу Ц 10 мл, у третю Ц 15 мл ≥ довести загальний обТЇм в двох перших проб≥рках до 15 мл дистильованою водою. “аким чином, умовна концентрац≥€ т≥осульфату у перш≥й проб≥рц≥ буде c1, у друг≥й Ц 2с1, у трет≥й Ц 3с1. ¬ окремих трьох проб≥рках приготувати по 5 мл розчину сульфатноњ кислоти.
” проб≥рку є1 з розчином натр≥й т≥осульфату влити розчин кислоти, включити секундом≥р ≥ записати час (секунди), за €кий зС€витьс€ помутн≥нн€ Ц в≥льна с≥рка. ƒосл≥д повторити з проб≥рками є2 ≥ є3. –езультати досл≥д≥в записати у таблицю:
“аблиц€ 4.1
| є досл. | V(Na2S2O3), мл | V(H2O), мл | V(H2SO4), мл | V загальний | C (конц) Na2S2O3 (умовна) | t, час, с | V=100/t, швидк≥сть с-1 |
| —1 | |||||||
| 2с1 | |||||||
| - | 3с1 |
ѕобудувати граф≥к залежност≥ швидкост≥ реакц≥њ в≥д концентрац≥њ реагент≥в, де на ос≥ абсцис в≥дкласти умовну концентрац≥ю — розчину т≥осульфату, а на ос≥ ординат Ц умовну швидк≥сть V=100/t. «робити висновок про вплив концентрац≥њ реагент≥в на швидк≥сть процес≥в.
ƒосл≥д 4. ¬плив концентрац≥й реагуючих речовин на х≥м≥чну р≥вновагу.
—тан х≥м≥чноњ р≥вноваги у систем≥ можна зм≥стити, зм≥нюючи концентрац≥њ реагент≥в або продукт≥в реакц≥њ. ƒл€ досл≥дженн€ приготувати 4 великих проб≥рки ≥ розчини ферум (≤≤≤) хлориду FeCl3, кал≥й родан≥ду KSCN та кристал≥чний кал≥й хлорид —l. ѕри взаЇмод≥њ ферум хлориду з кал≥й родан≥дом прот≥каЇ оборотна реакц≥€ з утворенн€м ферум (≤≤≤) родан≥ду червоного кольору. ≤нтенсивн≥сть червоного кольору залежить в≥д концентрац≥њ Fe(SCN)3 у розчин≥, тому що вс≥ ≥нш≥ реагенти безбарвн≥. «м≥щенн€ р≥вноваги у б≥к пр€моњ реакц≥њ зб≥льшуЇ ≥нтенсивн≥сть червоного кольору, зм≥щенн€ р≥вноваги у зворотний б≥к супроводжуЇтьс€ зменшенн€м ≥нтенсивност≥ забарвленн€.
” велику проб≥рку налити дистильованоњ води ≥ додати по 2-3 краплини розчин≥в ферум хлориду ≥ кал≥й родан≥ду до утворенн€ слабко - червоного розчину. ѕерем≥шати розчин ≥ розлити його на 4 проб≥рки приблизно пор≥вну. „етверта проб≥рка Ї проб≥ркою пор≥вн€нн€.
” першу та другу проб≥рки додати розчин FeCl3, та KSCN. ¬≥дм≥тити, €к зм≥нюЇтьс€ забарвленн€. ” третю проб≥рку додати кристал≥чний KCl, записати зм≥ну кольору. ѕо€снити, в €кому напр€мку зм≥щувалась р≥вновага у кожному випадку. —класти р≥вн€нн€ реакц≥њ ≥ записати вираз константи р≥вноваги. Ќа основ≥ принципу Ће-Ўателье по€снити вплив концентрац≥й речовин на х≥м≥чну р≥вновагу.
онтрольн≥ питанн€.
- Ќавести формулюванн€ ≥ математичний вираз закону д≥ючих мас. «аписати його вираз дл€ реакц≥й:
а) 2NOг + O2,г = 2NO2,г; б) 2Naкp.+ H2,r = 2NaHкp.
|
|
|
2. онстанта швидкост≥ реакц≥њ 2Ќ2 + ќ2 = 2Ќ2ќ, €ка в≥дбуваЇтьс€ у газов≥й фаз≥, дор≥внюЇ 2∙10-3 л/моль∙с. ќбчислити швидк≥сть V ц≥Їњ реакц≥њ, €кщо концентрац≥њ водню та кисню дор≥внюють по 0,2 моль/л.
3. ¬изначити, у ск≥льки раз≥в зросте швидк≥сть реакц≥њ при зб≥льшенн≥ температури на 300—. “емпературний коеф≥ц≥Їнт реакц≥њ дор≥внюЇ 3.
4. ѕо€снити, що таке х≥м≥чна р≥вновага, €к≥ фактори впливають на зм≥щенн€ х≥м≥чноњ р≥вноваги. ќбчислити константу р≥вноваги р≥вн. дл€ реакц≥њ:
Br2,p+ H2,r = 2HBrr, €кщо у стан≥ р≥вноваги концентрац≥њ реагент≥в були:
[Br2]=0,2 моль/л, [H2]=0,3 моль/л, [HBr] = 1,2 моль/л. ќбчислити початков≥ концентрац≥њ брому та водню.
5. «аписати вираз дл€ констант р≥вноваги р≥вн. дл€ реакц≥й у газов≥й фаз≥:
а) 2SO2 + O2 = 2SO3; H0298 = -192,7 кƒж/моль
б) H2 + Cl2 = 2HCl; H0298 = - 184,6 кƒж/моль
в) Cтверд. + H2O = CO + H2; H0298 = 129,9 кƒж/моль
«а величиною стандартноњ ентальп≥њ Ќ0298 визначити, €к≥ з цих реакц≥й Ї ендотерм≥чними, а €к≥ Ц екзотерм≥чними? ” €кому напр€мку зм≥ститьс€ р≥вновага у цих процесах, €кщо: а) зб≥льшити тиск –; б) зб≥льшити температуру?
Ћабораторна робота є5
–озчини. «агальн≥ властивост≥ розчин≥в
ќсновн≥ теоретичн≥ питанн€.
¬изначенн€ та класиф≥кац≥€ розчин≥в (за фазовим станом, за к≥льк≥стю розчиненоњ речовини); компоненти, €к≥ утворюють розчин; механ≥зм процесу розчиненн€; сольвати, г≥драти; розчини неелектрол≥т≥в; формулюванн€ та математичний вираз закон≥в –аул€ ≥ ¬ант-√оффа. «алежн≥сть розчинност≥ речовин в≥д температури.
ћета роботи: досл≥дити процеси розчиненн€ р≥дких, твердих, газопод≥бних речовин. ¬становити залежн≥сть розчинност≥ речовин в≥д температури. ¬ивчити зм≥ну температури при розчиненн≥ речовин.
ќбладнанн€ ≥ реактиви: кристал≥чн≥ речовини: йод, NH4NO3 або NaNO3, NaќЌ та Na—≤; розчини бензолу, спирту, гл≥церину; дистильована вода; проб≥рки, штатив з лапкою, газовий пальник, щипц≥, термометр.
’≥д роботи
ƒосл≥д 1. «м≥на температури при розчиненн≥ речовин.
” три проб≥рки налити до 1/3 обТЇму дистильованоњ води ≥ вим≥р€ти њњ температуру. ” першу проб≥рку всипати на к≥нц≥ шпателю (б≥л€ 1 г) кристалик≥в амон≥й н≥трату, розчинити його при перем≥шуванн≥ ≥ вим≥р€ти температуру. ” другу та третю проб≥рки додати 1-2 шматочки лугу та кристалики кухонноњ сол≥ в≥дпов≥дно ≥ п≥сл€ розчиненн€ вим≥р€ти температуру утворених розчин≥в.
«аписати спостереженн€. «робити висновок, €кими тепловими ефектами може супроводжуватись процес розчиненн€.
ƒосл≥д 2. «алежн≥сть розчинност≥ солей в≥д температури.
Ќалити у проб≥рку 0,5 мл розчину плюмбум(≤≤) н≥трату ≥ додати к≥лька крапель розчину кал≥й йодиду. —постер≥гати утворенн€ осаду та в≥дм≥тити його кол≥р. ƒолити в проб≥рку дистильовану воду (1/2 обТЇму) ≥ обережно нагр≥ти. оли вс€ с≥ль розчинитьс€, охолодити проб≥рку п≥д проточною водою. ¬≥дм≥тити утворенн€ кристал≥в Pbl2 з перенасиченого розчину.
«робити висновок про залежн≥сть розчинност≥ твердих речовин в≥д температури. ƒати визначенн€ насиченим ≥ ненасиченим розчинам.
ƒосл≥д 3. ”творенн€ сольват≥в.
ћолекул€рний йод маЇ ф≥олетове забарвленн€, €ке збер≥гаЇтьс€ у непол€рних розчинниках. якщо при розчиненн≥ утворюютьс€ сольвати йоду з розчинником, забарвленн€ зм≥нюЇтьс€.
” дв≥ проб≥рки покласти шпателем по кристалику йоду. ” першу проб≥рку налити 1 мл етанолу, у другу Ц 1 мл бензолу. ѕерем≥шати вм≥ст проб≥рок скл€ною паличкою. ¬≥дм≥тити забарвленн€ одержаних розчин≥в. «робити висновок, у €к≥й з проб≥рок утворивс€ сольват йоду.
ƒосл≥д 4. –озчинн≥сть р≥дини у вод≥.
” дв≥ проб≥рки налити приблизно по 1 мл дистильованоњ води ≥ обережно додати р≥вн≥ обТЇми: у першу Ц бензолу, у другу Ц гл≥церину. ¬≥дм≥тити розшаруванн€ р≥дин у проб≥рках. ѕерем≥шати вм≥ст проб≥рок скл€ною паличкою ≥ записати спостереженн€. «робити висновок про розчинн≥сть р≥дин у вод≥.
ƒосл≥д 5. –озчинн≥сть пов≥тр€ у тепл≥й ≥ холодн≥й вод≥.
|
|
|
ƒл€ досл≥ду вз€ти штатив з лапкою, ексикатор, велику проб≥рку. «аповнити ексикатор ≥ проб≥рку водопров≥дною водою. «акрити отв≥р проб≥рки пальцем, перегорнути њњ ≥ занурити в ексикатор з водою. «акр≥пити проб≥рку лапкою. ќбережно нагр≥вати проб≥рку вздовж ус≥Їњ довжини газовим пальником. ¬≥дм≥тити утворенн€ бульбашок газу у верхн≥й частин≥ проб≥рки ≥ њх рух донизу, а також вит≥сненн€ води з проб≥рки. ѕо€снити спостереженн€. «робити висновок про залежн≥сть розчинност≥ газ≥в в≥д температури.
онтрольн≥ питанн€.
1. ѕо€снити, що називають розчином, розчинником, розчиненою речовиною. ¬≥д €ких фактор≥в ≥ €к залежить розчинн≥сть твердих, р≥дких ≥ газопод≥бних речовин? ƒл€ €ких ц≥лей газован≥ напоњ перед вживанн€м охолоджують?
2. 140 г кал≥й дихромату розчинили при 800— у 200 мл води. ѕ≥сл€ кристал≥зац≥њ при 00— одержали 110 г чистоњ сол≥. який практичний вих≥д продукту (%)? («а таблицею розчинност≥ у 1 л води при 00— може розчинитись 50 г дихромату.)
3. ѕри розчиненн≥ 8 г нафтал≥ну у 250 г бензолу, температура кип≥нн€ останнього п≥двищилась на 0,640. ¬изначити молекул€рну масу нафтал≥ну. ≈бул≥оскоп≥чна константа бензолу дор≥внюЇ 2,560.
4. ѕри 00— осмотичний тиск розчину цукру —12Ќ22ќ11 дор≥внюЇ 3,55∙105 ѕа. яка маса цукру м≥ститьс€ в 1 л цього розчину? R = 8,314 ƒж/ ∙моль.
5. ѕри розчиненн≥ 5 г речовини в 200 г води утворюЇтьс€ розчин, €кий не проводить електричний струм ≥ замерзаЇ при -1,550—. ¬изначте мол€рну масу розчиненоњ речовини. р≥оскоп≥чна константа води дор≥внюЇ 1,860.
Ћабораторна робота є6
(≥ндив≥дуальна експериментально-розрахункова робота)
онцентрац≥€. ѕриготуванн€ розчин≥в з р≥зною концентрац≥Їю
ќсновн≥ теоретичн≥ питанн€.
—пособи вираженн€ концентрац≥њ розчину (масова частка, мол€рна та нормальна концентрац≥њ), способи приготуванн€ розчин≥в р≥зних концентрац≥й, формули переходу в≥д одн≥Їњ концентрац≥њ до ≥ншоњ, густина розчину.
ћета роботи: навчитисьрозраховувати масу розчиненоњ речовини та розчинника дл€ приготуванн€ розчину з певною масовою часткою розчиненоњ речовини та перераховувати процентну концентрац≥ю розчину в нормальну та мол€рну.
ќбладнанн€ ≥ реактиви: техно-х≥м≥чн≥ваги ≥ р≥зноваги; м≥рний цил≥ндр на 100 мл; плоскодонна колба.
’≥д роботи
ѕриготуванн€ розчину заданоњ процентноњ концентрац≥њ з твердоњ речовини та води
ƒл€ приготуванн€ розчину з заданою масовою часткою розчиненоњ речовини необх≥дно зважити розраховану к≥льк≥сть речовини, висипати наважку в колбу, долити в≥дм≥р€ний м≥рним цил≥ндром обТЇм води та ретельно перем≥шати. «а допомогою ареометра визначити густину приготованого розчину та пор≥вн€ти з табличним значенн€м (табл. 6.2.).
–озрахункова частина
«а ≥ндив≥дуальним завданн€м (табл. 6.1) розрахувати, ск≥льки сол≥ ≥ води необх≥дно вз€ти дл€ приготуванн€ розчину безводноњ сол≥ певноњ масовоњ частки. Ќомер вар≥анту в≥дпов≥даЇ пор€дковому номеру студента у списку.
“аблиц€ 6.1
| є вар≥анту | ќбТЇм розчину, мл | онц. розчину K2Cr2O7 | онц. розчину MgSO4 |
≤. ћасова частка розчиненоњ речовини (процентна концентрац≥€) (—, %) Ц це к≥льк≥сть грам розчиненоњ речовини, €ка м≥ститьс€ в 100 г розчину:
|
|
|
 ; mр-ну = V∙ρ,
; mр-ну = V∙ρ,
де mроз.реч . Ц маса розчиненоњ речовини, г;
mр-ну Ц маса розчину, г;
V Ц обТЇм розчину, мл;
ρ Ц густина розчину, г/см3.
“ому,  , зв≥дки
, зв≥дки  .
.
–озрахунок виконати, використовуючи наведен≥ вище формули. √устину розчину певноњ концентрац≥њ визначити з таблиц≥.
“аблиц€ 6.2






