Ћабораторне зан€тт€ є 2
“ема: ≤зомер≥€, номенклатура насичених вуглеводн≥в
ћета: «акр≥пити знанн€ про насичен≥ вуглеводн≥, про ≥зомер≥ю насичених вуглеводн≥в. Ќавчити писати ≥зомери насичених вуглеводн≥в, називати њх зг≥дно номенклатури ≤ёѕј
’≥д зан€тт€
I. “еоретичн≥ питанн€ теми:
1. як≥ речовини називаютьс€ насиченими вуглеводн€ми. Ќавести приклади.
2. ≤зомер≥€ насичених вуглеводн≥в. ѕравила написанн€ ≥зомер≥в.
3. ѕросторова ≥зомер≥€ насичених вуглеводн≥в.
4. Ќоменклатура насичених вуглеводн≥в. ѕривести приклади.
«авданн€ дл€ самоп≥дготовки
1. ¬ивчити визначенн€, €к≥ речовини називаютьс€ вуглеводн€ми; насиченими вуглеводн€ми. Ќавести приклади.
2. ƒайте означенн€ ≥зомер≥в.
3. ” чому пол€гаЇ причина ≥зомер≥њ?
4. Ќапиш≥ть та назв≥ть за науковою номенклатурою ≤ёѕј ≥зомери октану.
5. „и Ї ≥ндив≥дуальними сполуками: а) ≥зомери; б) конформери? ¬≥дпов≥дь по€сн≥ть.
II. онтрольна робота
III. Ћ≥тература:
1. ‘.‘.ЅоЇчко, ¬.ћ.Ќайдан, ¬.ћ.«ахарик, Ќ.ћ.«ахарченко. ќрган≥чна х≥м≥€. .: ¬ища школа, 1986.с.33-38.
2. ј.¬.ƒомбровський, ¬.ћ.Ќайдан. ќрган≥чна х≥м≥€. Ц .: ¬ища школа, 1992.с. 35-41.
3. ј.ј.ѕетров, ’.¬.Ѕаль€н, ј.√. “рощенко. ќрганическа€ хими€. Цћ.: ¬ысша€ школа, 1981. с.51-54.
Ћабораторне зан€тт€ є 3
“ема: ќдержанн€ ≥ х≥м≥чн≥ властивост≥ метану ≥ гексану
ћета: Ќавчитис€ добувати метан; проводити досл≥ди на п≥дтвердженн€ ф≥зичних та х≥м≥чних властивостей метану, гексану, монтувати найпрост≥ш≥ прилади дл€ добуванн€ газ≥в. «вернути увагу на техн≥ку безпеки при робот≥ з метаном
’≥д зан€тт€
I. “еоретичн≥ питанн€ теми:
1. ўо називають насиченими вуглеводн€ми?
2. √омолог≥чний р€д, радикали.
3. ‘≥зичн≥ властивост≥ метану, гексану.
4. ’≥м≥чн≥ властивост≥ метану (хлоруванн€, окисненн€, сульфуванн€, н≥труванн€).
5. ƒобуванн€ метану.
6. ’≥м≥чн≥ властивост≥ гексану.
II. ћетодика виконанн€ досл≥д≥в
1) ќдержанн€ метану та вивченн€ його властивостей: в≥дношенн€ до бромноњ води та водного розчину перманганату кал≥ю, гор≥нн€ / 4 / є 7 (ј).
–еактиви: сум≥ш дл€ добуванн€ метану Ц ацетат кал≥ю або ацетат натр≥ю (безводний, плавлений), натронне вапно св≥жо приготовлене (1:2), перманганат кал≥ю (1%-й розчин); бромна вода, мило, гл≥церин, ам≥ак (25%-й розчин).
ќбладнанн€: прилад дл€ добуванн€ метану, фарфорова чашка; кристал≥затор.
’≥д роботи.
ѕ≥дготовка до виконанн€ досл≥ду:
1) —кладаЇмо прилад зг≥дно малюнку. ѕрилад перев≥р€Їмо на герметичн≥сть.
2) √отуЇмо дв≥ проб≥рки, в €к≥ попередньо наливаЇмо:
а) в одну Ц 1-2мл бромноњ води;
б) в другу Ц 1-2 мл 1% розчину перманганату кал≥ю.
—тавимо проб≥рки з налитими розчинами в штатив дл€ проб≥рок.
’≥д досл≥ду
Ќа аркуш паперу насипаЇмо 1 частину ацетату натр≥ю ≥ 2 частини натронного вапна, перем≥шуЇмо скл€ною паличкою ≥ насипаЇмо у суху проб≥рку на ¼ њњ вм≥сту. ѕроб≥рку закриваЇмо пробкою з газов≥дв≥дною трубкою, закр≥плюЇмо у лапц≥ штативу з невеликим нахилом у б≥к пробки. ÷е робл€ть дл€ того, щоб проб≥рка не тр≥снула п≥д час потрапл€нн€ на нењ води, що може вид≥литис€ з недостатньо прожарених ацетату натр≥ю ≥ натронного вапна.
|
|
|
≥нець газов≥дв≥дноњ трубки п≥дводимо п≥д перевернуту догори дном проб≥рку з водою, €ку вм≥щуЇмо у кристал≥затор.
—початку прогр≥ваЇмо у полумТњ спирт≥вки усю проб≥рку, а пот≥м сильно нагр≥ваЇмо сум≥ш на дн≥ проб≥рки. Ќагр≥ваючи, поступово перем≥щуЇмо полумТ€ так, щоб нагр≥лас€ вс€ сум≥ш. ѕерш, н≥ж збирати метан у проб≥рку, перев≥р€Їмо, чи вид≥л€Їтьс€ в≥н. ƒл€ цього к≥нець газов≥дв≥дноњ трубки опускаЇмо в кристал≥затор з водою ≥ до бульбашок газу, що вид≥л€ютьс€, п≥дносимо запалений с≥рник. якщо газ спалахуЇ, то метан можна збирати у проб≥рку.
ћетан пропускаЇмо через бромну воду прот€гом 10-15 секунд, а пот≥м через розчин перманганату кал≥ю. ∆одних зм≥н у проб≥рках не спостер≥гаЇтьс€, реактиви не знебарвлюютьс€.
¬ ≥ншу проб≥рку збираЇмо метан над водою, виймаЇмо ≥з кристал≥затора, в≥дразу закриваЇмо њњ. ¬≥дкриваЇмо проб≥рку, €ку заповнили метаном, до отвору проб≥рки п≥дносимо запалений с≥рник ≥ одночасно наливаЇмо в нењ воду з промивали або з ≥ншоњ проб≥рки.
—постер≥гаЇмо гор≥нн€ метану голубим полумТ€м.
¬исновок. ћетан Ц безбарвний газ, легший за пов≥тр€. Ќе знебарвлюЇ бромну воду ≥ розчин перманганату кал≥ю. ћетан Ц насичений вуглеводень.
2) ¬ластивост≥ р≥дких насичених вуглеводн≥в
–еактиви: н-гексан або ≥нш≥ р≥дк≥ насичен≥ вуглеводн≥, бром, бромна вода (насичений розчин); перманганат кал≥ю (1%-й розчин); с≥рчана кислота (концентрована); ам≥ак (25%-й розчин).
ќбладнанн€: електрична лампочка (200-300¬т) або фото лампа з матовим склом (500¬т); скл€на паличка, м≥кро п≥петка; син≥й лакмусовий пап≥рець.
а) в≥дношенн€ р≥дких насичених вуглеводн≥в до бромноњ води та водного розчину перманганату кал≥ю: у дв≥ проб≥рки наливають по 1мл н-гексану або ≥ншого р≥дкого насиченого вуглеводню. ѕ≥сл€ цього до одноњ з них добавл€ють 0,5мл бромноњ води, а до ≥ншоњ Ц 0,5мл 1%-ного розчину перманганату кал≥ю. –еакц≥йн≥ сум≥ш≥ в проб≥рках ≥нтенсивно перем≥шують. Ќ≥€ких зм≥н кольору розчин≥в у проб≥рках не спостер≥гаЇтьс€.
Ѕром ≥ водний розчин перманганату кал≥ю не знебарвлюютьс€. ” проб≥рц≥ з бромною водою гексан екстрагуЇ бром ≥з водного розчину. “ому верхн≥й шар сум≥ш≥, в €к≥й м≥ститьс€ гексан, забарвлюЇтьс€ бромом.
б) бромуванн€ р≥дких алан≥в на св≥тл≥: у суху проб≥рку наливають 1 мл
н-гексану або ≥ншого р≥дкого насиченого вуглеводню ≥ до нього м≥кро п≥петкою добавл€ють одну краплю брому. Ѕром розчин€Їтьс€ в гексан≥ ≥ забарвлюЇ його в бурий кол≥р, €кий не зникаЇ при сто€нн≥ реакц≥йноњ сум≥ш≥. ѕот≥м реакц≥йну сум≥ш у проб≥рц≥ ≥нтенсивно осв≥тлюють електричною лампочкою. —постер≥гаЇтьс€ поступове знебарвленн€ брому ≥ утворенн€ бромоводню, €кий ви€вл€ють, внос€чи в отв≥р проб≥рки п≥нцетом змочений водою син≥й лакмусовий пап≥рець або скл€ну паличку, змочену концентрованим (25%-м) розчином ам≥аку (утворюЇтьс€ б≥лий туман бром≥ду амон≥ю).
ќтже, дл€ насичених вуглеводн≥в характерними Ї реакц≥њ зам≥щенн€ водню, €к≥ легко в≥дбуваютьс€ на св≥тл≥.
III. ¬исновок зан€тт€
IV. ƒомашнЇ завданн€
V. ѕитанн€, винесен≥ на самост≥йне опрацюванн€:
1. ѕромислов≥ методи синтезу насичених вуглеводн≥в.
2. ‘≥зичн≥ властивост≥ насичених вуглеводн≥в.
3. Ќародногосподарське значенн€ насичених вуглеводн≥в.
VI. Ћ≥тература:
1. ‘.‘.ЅоЇчко, ¬.ћ.Ќайдан, ¬.ћ.«ахарик, Ќ.ћ.«ахарченко. ќрган≥чна х≥м≥€. .: ¬ища школа, 1986.с.10-14, 31-45.
|
|
|
2. ¬.ћ.Ќайдан. ќрган≥чна х≥м≥€. ћалий лабораторний практикум. Ц .: ¬ища школа, 1994.с.19-20
Ћабораторне зан€тт€ є 4
“ема: Ќасичен≥ вуглеводн≥ (јлкани)
ћета: Ќа основ≥ положень теор≥њ х≥м≥чноњ будови орган≥чних речовин ќ.ћ. Ѕутлерова розгл€нути будову, взаЇмний вплив атом≥в в молекул≥, х≥м≥чн≥ властивост≥ насичених вуглеводн≥в
I. “еоретичн≥ питанн€ теми:
1. ’арактеристика алкан≥в, гомолог≥чний р€д, радикали.
2. ѕросторова будова алкан≥в.
3. ≈лектронна будова алкан≥в, sp3-г≥бридизац≥€, σ-звТ€зок.
4. ћетоди добуванн€ насичених вуглеводн≥в.
5. ‘≥зичн≥ властивост≥ насичених вуглеводн≥в.
6. ’≥м≥чн≥ властивост≥ насичених вуглеводн≥в.
7. а) ћехан≥зм реакц≥њ атомарно-радикального зам≥щенн€.
8. б) –еакц≥њ галогенуванн€.
9. в) –еакц≥њ н≥труванн€, сульфуванн€, окисненн€, крек≥нгу.
10.¬заЇмний вплив атом≥в в молекул≥ насичених вуглеводн≥в.
11.Ќародно-господарське значенн€ алкан≥в.
II. онтрольна робота
III Ћ≥тература:
1. ј.¬.ƒомбровський, ¬.ћ.Ќайдан. ќрган≥чна х≥м≥€. Ц .: ¬ища школа, 1992. с. 34 Ц 56
2. ‘.‘.ЅоЇчко, ¬.ћ.Ќайдан, ¬.ћ.«ахарик, Ќ.ћ.«ахарченко. ќрган≥чна х≥м≥€. .: ¬ища школа, 1986. с. 31 Ц 45
3. ј.ј.ѕетров, ’.¬.Ѕаль€н, ј.√. “рощенко. ќрганическа€ хими€. Цћ.: ¬ысша€ школа, 1981. с. 50 Ц 95
Ћабораторне зан€тт€ є 5
“ема: ќдержанн€ ≥ х≥м≥чн≥ властивост≥ етилену та ацетилену
ћета: Ќавчитис€ добувати етилен, ацетилен та проводити досл≥ди на п≥дтвердженн€ њх властивостей етилену ≥ ацетилену. «вернути увагу на техн≥ку безпеки при робот≥ з етиленом ≥ ацетиленом
I. онтрольна робота
II. “еоретичн≥ питанн€ теми:
1. ’арактеристика етиленових ≥ ацетиленових вуглеводн≥в. Ќавести приклади
2. Ѕромуванн€ етилену ≥ ацетилену.
3. ќкисненн€ етилену ≥ ацетилену розчином MnO4.
4. ќдержанн€ ацетилен≥д≥в.
5. √ор≥нн€ етилену ≥ ацетилену.
6. ƒобуванн€ етилену ≥ ацетилену.
7. ѕравила безпечноњ роботи з етиленом ≥ ацетиленом.
III. ћетодика виконанн€ лабораторних досл≥д≥в
1) ƒобуванн€ етилену / 4 / є 9 (ј), с. 22.
–еактиви: етиловий спирт (96%), сульфатна кислота концентрована (Ќ2Sќ4); п≥сок, бромна вода (насичений розчин); перманганат кал≥ю (1%-й), натронне вапно.
ќбладнанн€: прилад дл€ добуванн€ етилену, хлоркальц≥Їв≥ трубки, заповнен≥ натронним вапном, фарфоровий шпатель.
ƒобуванн€ етилену.
” суху проб≥рку приладу дл€ добуванн€ етилену внос€ть приблизно 1г сухого п≥ску, 1мл етилового спирту ≥, обережно перем≥шуючи сум≥ш скл€ною паличкою, добавл€ють невеликими порц≥€ми 2мл концентрованоњ сульфатноњ кислоти. —тежать за тим, щоб сп≥вв≥дношенн€ спирту ≥ кислоти становило 1:2. у раз≥ зм≥шуванн€ етилового спирту ≥з сульфатною кислотою утворюЇтьс€ етил с≥рчана кислота (кислий складний еф≥р спирту ≥ с≥рчаноњ кислоти) ≥ реакц≥йна сум≥ш досить сильно роз≥гр≥ваЇтьс€. —постер≥гають за вид≥ленн€м газу етилену ≥ почорн≥нн€м реакц≥йноњ сум≥ш≥. ќдержаний етилен зразу ж використовують дл€ досл≥д≥в. —початку вивчають в≥дношенн€ його до бромноњ води ≥ розчину перманганату кал≥ю, а пот≥м досл≥джують його гор≥нн€.
 Ќ3—Ц—Ќ2ЦќЌ + ЌќSќ3Ќ Ќ3—Ц—Ќ2≠ЦќЦSќ3Ќ + Ќ2ќ
Ќ3—Ц—Ќ2ЦќЌ + ЌќSќ3Ќ Ќ3—Ц—Ќ2≠ЦќЦSќ3Ќ + Ќ2ќ
≈тилс≥рчана кислота
|
 Ќ3—Ц—Ќ2≠ЦќЦSќ3Ќ Ќ2—=—Ќ2 + Ќ2Sќ4
Ќ3—Ц—Ќ2≠ЦќЦSќ3Ќ Ќ2—=—Ќ2 + Ќ2Sќ4
≈тилен
2) Ѕромуванн€ етилену / 4 / є 9 (Ѕ), с. 24.
” проб≥рку наливають 1мл бромноњ води. «вужений к≥нець газов≥дв≥дноњ трубки приладу, в €кому добувають етилен, опускають у бромну воду ≥ пропускають через нењ етилен. —постер≥гають, €к бромна вода досить швидко знебарвлюЇтьс€ етиленом (€к≥сна реакц≥€ на подв≥йний звТ€зок).
 Ќ2—=—Ќ2 + BrЦBr BrЦCH2ЦCH2ЦBr
Ќ2—=—Ќ2 + BrЦBr BrЦCH2ЦCH2ЦBr
1,2-дибромоетан
3) ќкисненн€ етилену / 4 / є 9 (¬), с. 24.
 ” проб≥рку наливають 1мл 1%-ного розчину перманганату кал≥ю ≥ через нього пропускають етилен. —постер≥гають, €к ф≥олетове забарвленн€ перманганату кал≥ю зникаЇ, утворюЇтьс€ осад оксиду марганцю (≤V) бурого кольору (€к≥сна реакц≥€ на подв≥йний звТ€зок).
” проб≥рку наливають 1мл 1%-ного розчину перманганату кал≥ю ≥ через нього пропускають етилен. —постер≥гають, €к ф≥олетове забарвленн€ перманганату кал≥ю зникаЇ, утворюЇтьс€ осад оксиду марганцю (≤V) бурого кольору (€к≥сна реакц≥€ на подв≥йний звТ€зок).
|
|
|
 3Ќ2—=—Ќ2 + 2 MnO4 + 4H2O 3CH2ЦCH2 + 2MnO2 + 2KOH
3Ќ2—=—Ќ2 + 2 MnO4 + 4H2O 3CH2ЦCH2 + 2MnO2 + 2KOH
 | |||
 | |||
ќЌ ќЌ
етиленгл≥коль
4) √ор≥нн€ етилену / 4 / є 9 (√), с. 24.
Ќе припин€ючи нагр≥вати сум≥ш дл€ добуванн€ етилену, звужений к≥нець газов≥дв≥дноњ трубки, з €коњ вид≥л€Їтьс€ етилен, розм≥щують вертикально. ѕ≥дпалюють етилен поблизу к≥нц€ газов≥дв≥дноњ трубки. —постер≥гають, €к в≥н горить св≥тлим полумТ€м. ” полумТ€ внос€ть фарфоровий шпатель, на €кому досить швидко утворюЇтьс€ чорний нал≥т саж≥ (аморфного вуглецю), €ка св≥дчить про неповне окисненн€ етилену.
 Ќ2—=—Ќ2 + 3ќ2 2—ќ2 + 2Ќ2ќ
Ќ2—=—Ќ2 + 3ќ2 2—ќ2 + 2Ќ2ќ
5) ƒобуванн€ ацетилену / 4 / є 15 (ј), с. 31.
–еактиви: карб≥д кальц≥ю (у кусочках); бромна вода (насичений розчин); перманганат кал≥ю (1%-ний розчин), мило.
ќбладнанн€: прилад дл€ добуванн€ ацетилену.
ƒосл≥д провод€ть п≥д вит€жною шафою. Ќевелик≥ к≥лькост≥ ацетилену зручно отримувати в прилад≥, €кий складаЇтьс€ з проб≥рки, €ка маЇ отв≥р у дн≥. ÷€ проб≥рка закрита пробкою з газов≥дв≥дною гумовою трубкою ≥з затискачем. Ќа дно сухоњ проб≥рки кладуть невеликий шар скл€ноњ вати, на нього Ц 3-4 кусочки карб≥ду кальц≥ю, зверху Ц скл€ну вату. «атискач на газов≥дв≥дн≥й трубц≥ закривають. ѕроб≥рку закр≥плюють на штатив≥. ѕ≥д проб≥рку ставл€ть стакан, в €кий наливають воду. –≥вень води в стакан≥ повинен бути набагато вищим в≥д шару карб≥ду кальц≥ю в проб≥рц≥. ¬≥дкривають затискач. ¬ода через отв≥р надходить у проб≥рку ≥ взаЇмод≥Ї з карб≥дом кальц≥ю. јцетилен, €кий при цьому утворюЇтьс€, в≥двод€ть ≥з проб≥рки через газов≥дв≥дну трубку. якщо затискач закрити, то реакц≥€ в проб≥рц≥ зупин€Їтьс€. “аким способом легко регулювати вид≥ленн€ ацетилену.


 C ЌЦќЌ —Ќ
C ЌЦќЌ —Ќ

 Cа + + —а(ќЌ)2
Cа + + —а(ќЌ)2
— ЌЦќЌ —Ќ
арб≥д јцетилен
кальц≥ю
ќдержаний ацетилен одразу використовують дл€ досл≥д≥в. —початку вивчають в≥дношенн€ його до бромноњ води ≥ розчину перманганату кал≥ю, а пот≥м досл≥джують гор≥нн€ ацетилену. “акий пор€док проведенн€ досл≥д≥в зумовлений тим, що ацетилен, необх≥дний дл€ гор≥нн€, повинен бути чистим ≥ не м≥стить дом≥шок, з €кими в≥н утворюЇ вибухонебезпечн≥ сум≥ш≥.
6) Ѕромуванн€ ацетилену / 4 / є 15 (Ѕ), с. 32.
” проб≥рку наливають 1мл бромноњ води ≥ через нењ пропускають ацетилен. —постер≥гають за знебарвленн€м бромноњ води, оск≥льки бром приЇднуЇтьс€ за м≥сцем потр≥йного звТ€зку ацетилену.
Br Br
Br2 │ │

 ЌЦ—≡—ЦЌ + Br2 Ќ—=—Ќ ЌЦ—Ц—ЦЌ
ЌЦ—≡—ЦЌ + Br2 Ќ—=—Ќ ЌЦ—Ц—ЦЌ
│ │ │ │
Br Br Br Br
1,2-ƒиброметан 1,1,2,2-“етраброметан
7) –еакц≥€ ацетилену з KMnO4 / 4 / є 15 (¬), с. 32.
” проб≥рку наливають 1мл 1%-ного розчину перманганату кал≥ю ≥ через нього пропускають ацетилен. —постер≥гають, €к ф≥олетове забарвленн€ перманганату кал≥ю зникаЇ ≥ утворюЇтьс€ осад оксиду марганцю (≤V) бурого кольору. ѕ≥д час окисненн€ ацетилену також розриваЇтьс€ потр≥йний звТ€зок.
ќ ќ
 | |||
 | |||
 3ЌЦ—≡—ЦЌ + 8 MnO4 3 CЦC + 8MnO2 + 2 ќЌ + 2Ќ2ќ
3ЌЦ—≡—ЦЌ + 8 MnO4 3 CЦC + 8MnO2 + 2 ќЌ + 2Ќ2ќ
║ ║
O O
ќксалат кал≥ю
8) √ор≥нн€ ацетилену / 4 / є 15 (√), с. 33
≥нець газов≥дв≥дноњ трубки, з €коњ вид≥л€Їтьс€ ацетилен, опускають у фарфорову чашку, наповнену мильною водою (1г мила, 30-40мл води). ƒо мильних бульбашок, €к≥ при цьому утворюютьс€, п≥днос€ть запалену скалку. —постер≥гають, €к ацетилен горить к≥пт€вим полумТ€м. ”творенн€ к≥пт€ви св≥дчить про високий процентний вм≥ст арбону в ацетилен≥ ≥ неповне його окисненн€ в процес≥ гор≥нн€ на пов≥тр≥. Ќапиш≥ть р≥вн€нн€ реакц≥њ гор≥нн€ ацетилену ≥ розставте коеф≥ц≥Їнти. ќбчисл≥ть масов≥ частки арбону (у процентах) у метан≥, етилен≥ ≥ ацетилен≥ та пор≥вн€йте њх. —к≥льки л≥тр≥в пов≥тр€ потр≥бно дл€ повного згор€нн€ 1л кожного ≥з цих вуглеводн≥в?
|
|
|
 2Ќ—≡—Ќ + 5ќ2 4—ќ2 + 2Ќ2ќ
2Ќ—≡—Ќ + 5ќ2 4—ќ2 + 2Ќ2ќ
9) ƒобуванн€ ацетилен≥ду ср≥бла / 4 / є 16 (Ѕ), с. 34
” проб≥рку внос€ть 1-2мл 1%-ного розчину н≥трату ср≥бла ≥ крапл€ми до нього добавл€ють 5%-ний розчин ам≥аку до повного розчиненн€ осаду оксиду ср≥бла, €кий спочатку утворюЇтьс€. „ерез одержаний безбарвний розчин ам≥акату г≥дроксиду ср≥бла пропускають ацетилен. ¬ипадаЇ жовтувато-с≥рий осад ацетилен≥ду ср≥бла.
јцетилен≥д ср≥бла дуже вибухонебезпечний ≥ в≥дф≥льтровувати його з реакц≥йноњ сум≥ш≥ не можна. ѕ≥сл€ проведенн€ досл≥ду його одразу руйнують. ƒл€ цього до реакц≥йноњ сум≥ш≥, де м≥ститьс€ ацетилен≥д ср≥бла, добавл€ють концентровану сол€ну кислоту, €ка розкладаЇ ацетилен≥д.
 ЌЦ—≡—ЦЌ + 2[Ag(NH3)]ќЌ AgЦ—≡—ЦAg↓ + 4 NH3 + 2Ќ2ќ
ЌЦ—≡—ЦЌ + 2[Ag(NH3)]ќЌ AgЦ—≡—ЦAg↓ + 4 NH3 + 2Ќ2ќ
јцетилен≥д
—р≥бла
”творенн€ ацетилен≥д≥в Ї €к≥сною реакц≥Їю на ацетиленовий водень.
IV. ¬исновок зан€тт€
V. ƒомашне завданн€
VI. Ћ≥тература:
1. ј.¬.ƒомбровський, ¬.ћ.Ќайдан. ќрган≥чна х≥м≥€. Ц .: ¬ища школа, 1992. с. 111 Ц 135, 148 Ц 158
2. ‘.‘.ЅоЇчко, ¬.ћ.Ќайдан, ¬.ћ.«ахарик, Ќ.ћ.«ахарченко. ќрган≥чна х≥м≥€. .: ¬ища школа, 1986. с. 47 Ц 63, 59 Ц63
3. ј.ј.ѕетров, ’.¬.Ѕаль€н, ј.√. “рощенко. ќрганическа€ хими€. Цћ.: ¬ысша€ школа, 1981. с. 69 Ц 85, 88 Ц 95
4. ¬.ћ.Ќайдан. ќрган≥чна х≥м≥€. ћалий лабораторний практикум. Ц .: ¬ища школа, 1994
Ћабораторне зан€тт€ є 6
“ема: ƒ≥Їнов≥ вуглеводн≥. аучуки
ћета: ¬ивчити будову д≥Їнових вуглеводн≥в. Ќа основ≥ взаЇмного впливу атом≥в в молекул≥ вм≥ти по€снювати х≥м≥чн≥ властивост≥ д≥Їн≥в. ¬ивчити будову ≥ х≥м≥чн≥ властивост≥ натурального ≥ синтетичного каучук≥в
I. “еоретичн≥ питанн€ теми:
1.’арактеристика ≥ класиф≥кац≥€ д≥Їнових вуглеводн≥в. Ќавести приклади.
2.≤зомер≥€ ≥ номенклатура д≥Їнових вуглеводн≥в.
3.ћетоди синтезу д≥Їнових вуглеводн≥в.
4.’≥м≥чн≥ властивост≥ спр€жених д≥Їн≥в на приклад≥ бутад≥Їну.
5.Ќатуральний каучук. Ѕудова, властивост≥.
6.¬улкан≥зац≥€ каучук≥в.
7.—интетичн≥ каучуки: бутад≥Їновий (— Ѕ), ≥зопреновий (— ≤), стирольний (— —), н≥трильний (— Ќ).
8.√ума.
II. онтрольна робота
III. Ћ≥тература:
1. ‘.‘.ЅоЇчко, ¬.ћ.Ќайдан, ¬.ћ.«ахарик, Ќ.ћ.«ахарченко. ќрган≥чна х≥м≥€. .: ¬ища школа, 1986. с. 59-65
2. ј.¬.ƒомбровський, ¬.ћ.Ќайдан. ќрган≥чна х≥м≥€. Ц .: ¬ища школа, 1992. с. 148-161
Ћабораторне зан€тт€ є 7
“ема: Ќенасичен≥ вуглеводн≥
ћета: «акр≥пити знанн€ про будову, х≥м≥чн≥ властивост≥, взаЇмний вплив атом≥в в молекулах етиленових, д≥Їнових та ацетиленових вуглеводн≥в. «нати натуральний, синтетичний каучуки та њх застосуванн€
I. онтрольна робота
II. “еоретичн≥ питанн€ теми:
III.
1. √омолог≥чний р€д етиленових ≥ ацетиленових вуглеводн≥в.
2. ≈лектронна будова етилену ≥ ацетилену.
3. ќсновн≥ методи синтезу етилену ≥ ацетилену.
4. ’≥м≥чн≥ властивост≥ етилену (г≥друванн€, г≥дрогенгалогенуванн€, бромуванн€, г≥дратац≥€, окисненн€, озонуванн€, пол≥меризац≥€,).
5. ѕравило ћарковн≥кова. ¬иключенн€ з правила ћарковн≥кова.
6. ’≥м≥чн≥ властивост≥ ацетилену: г≥друванн€, г≥дрогенгалогенуванн€, окисненн€, г≥дратац≥€, взаЇмод≥€ ≥з спиртами, карбоновими кислотами, з Ќ—N з металами. ѕон€тт€ про ацетилен≥ди.
7. ≈лектронна будова бутад≥Їну. π,π- спр€женн€.
8. ’≥м≥чн≥ властивост≥ бутад≥Їну (г≥друванн€, г≥дрогенгалогенуванн€, бромуванн€, реакц≥€ ƒ≥льса-јльдера).
9. Ќатуральний каучук.
10.—интетичн≥ каучуки: — Ѕ, — ≤, — —, — Ќ.
11.√ума.
12.«астосуванн€ ненасичених вуглеводн≥в та њх пох≥дних.
III. ¬исновок зан€тт€
IV. ƒомашнЇ завданн€
V. Ћ≥тература:
1. ј.¬.ƒомбровський, ¬.ћ.Ќайдан. ќрган≥чна х≥м≥€. Ц .: ¬ища школа, 1992. с. 111 Ц 135, 148 Ц 158
2. ‘.‘.ЅоЇчко, ¬.ћ.Ќайдан, ¬.ћ.«ахарик, Ќ.ћ.«ахарченко. ќрган≥чна х≥м≥€. .: ¬ища школа, 1986. с. 47 Ц 63, 59 Ц 63
3. ј.ј.ѕетров, ’.¬.Ѕаль€н, ј.√. “рощенко. ќрганическа€ хими€. Цћ.: ¬ысша€ школа, 1981. с. 69 Ц 85, 88 Ц 95
Ћабораторне зан€тт€ є 8
“ема: √алогенопох≥дн≥ насичених та ненасичених вуглеводн≥в
ћета: ¬ивчити електронну будову, взаЇмний вплив атом≥в в молекул≥ галогенпох≥дних ненасичених та насичених вуглеводн≥в, њх х≥м≥чн≥ властивост≥ та основн≥ методи добуванн€
I. онтрольна робота
II. “еоретичн≥ питанн€ теми:
1. ’арактеристика галогенпох≥дних, гомолог≥чний р€д, класиф≥кац≥€.
2. ≤зомер≥€, номенклатура.
3. ≈лектронна будова галогенпох≥дних, ≥ндукц≥йний ефект, пол€рн≥сть, пол€ризуЇм≥сть звТ€зк≥в —ЦЌаl.
|
|
|
4. ¬заЇмний вплив атом≥в в молекулах насичених ≥ ненасичених галогенопох≥дних.
5. ѕор≥вн€нн€ активност≥ галогену в молекулах —Ќ3Ц—l, —Ќ3Ц—Ќ2Ц—l, —Ќ2=—ЌЦ—l, —Ќ2=—ЌЦ—Ќ2Ц—l.
6. ’≥м≥чн≥ властивост≥ галогенопох≥дних /реакц≥њ з водою, водними розчинами луг≥в, алкогол€тами, сол€ми карбонових кислот, ц≥ан≥дами, металами /. ƒег≥дрогалогенуванн€. ѕравило «айцева.
7. ’≥м≥чн≥ властивост≥ хлористого в≥н≥лу ≥ хлористого ал≥лу / реакц≥њ за участю подв≥йного звТ€зку та атому хлору/.
8. Ќайважлив≥ш≥ представники галогенопох≥дних та њх застосуванн€.
III. ¬исновок зан€тт€
IV. ƒомашнЇ завданн€
V. Ћ≥тература:
1. ј.¬.ƒомбровський, ¬.ћ.Ќайдан. ќрган≥чна х≥м≥€. Ц .: ¬ища школа, 1992. с. 56Ц70
2. ‘.‘.ЅоЇчко, ¬.ћ.Ќайдан, ¬.ћ.«ахарик, Ќ.ћ.«ахарченко. ќрган≥чна х≥м≥€. .: ¬ища школа, 1986. с. 100Ц102, 107
3. ј.ј.ѕетров, ’.¬.Ѕаль€н, ј.√. “рощенко. ќрганическа€ хими€. Цћ.: ¬ысша€ школа, 1981. с. 105Ц117
Ћабораторне зан€тт€ є 9
“ема: ’≥м≥чн≥ властивост≥ метанолу, етанолу та гл≥церину
ћета: Ќавчитис€ проводити досл≥ди на п≥дтвердженн€ ф≥зичних ≥ х≥м≥чних властивостей одноатомних ≥ багатоатомних спирт≥в. «вернути увагу на техн≥ку безпеки при робот≥ ≥з спиртами
I. онтрольна робота
II. “еоретичн≥ питанн€ теми:
1.’арактеристика спирт≥в. √омолог≥чний р€д.
2. ласиф≥кац≥€ спирт≥в.
3.ќсновн≥ представники класу спирт≥в.
4.’≥м≥чн≥ властивост≥ одноатомних спирт≥в на приклад≥ етилового спирт (утворенн€ алкогол€т≥в, простих еф≥р≥в, складних еф≥р≥в, окисненн€).
5.’≥м≥чн≥ властивост≥ багатоатомних спирт≥в на приклад≥ гл≥церину (реакц≥€ з —u(ќЌ)2).
III. ћетодика виконанн€ лабораторних досл≥д≥в
1) –озчинн≥сть ≥ нейтральн≥сть спирт≥в / 4 / є 26 (ј,Ѕ), с. 42.
–еактиви: спирти (метиловий, етиловий, проп≥ловий,бутиловий, ам≥ловий або ≥зоам≥ловий), фенолфталењн (1%-ний спиртовий розчин).
ќбладнанн€: проб≥рки, лакмусов≥ пап≥рц≥ син≥й ≥ червоний.
’≥д роботи
ƒосл≥д провод€ть у пТ€ти проб≥рках.
” першу з них наливають 0,5мл метилового спирту,
у другу Ц 0,5мл етилового спирту,
у третю Ц 0,5мл проп≥лового спирту,
у четверту Ц 0,5мл бутилового спирту,
у пТ€ту Ц 0,5мл ам≥лового або ≥зоам≥лового спирту.
«вертають увагу на запах цих спирт≥в. ѕот≥м у кожну проб≥рку добавл€ють по 1мл води ≥ сум≥ш спирту з водою добре перем≥шують струшуванн€м.
—постер≥гають, що нижч≥ спирти (метиловий, етиловий, проп≥ловий) добре розчин€ютьс€ у вод≥, утворюючи з нею гомогенн≥ розчини, а бутиловий ≥ ам≥ловий Ц погано, утворюючи з водою емульс≥њ.
¬≥дношенн€ водних розчин≥в спирт≥в до ≥ндикатор≥в
ƒл€ досл≥дженн€ використовують водн≥ розчини спирт≥в, одержан≥ в попередньому досл≥д≥.
≤з кожноњ проб≥рки беруть по одн≥й крапл≥ розчину ≥ нанос€ть його на син≥й ≥ червоний лакмусовий пап≥р. ѕ≥сл€ цього в кожну проб≥рку добавл€ють по одн≥й крапл≥ 1%-ного спиртового розчину фенолфталењну. ¬одн≥ розчини спирт≥в не зм≥нюють забарвленн€ ≥ндикатор≥в. ¬они нейтральн≥.
2) ќдержанн€ ≥ властивост≥ етилату натр≥ю / 4 / є 29, с. 44.
–еактиви: етиловий спирт (абсолютний), натр≥й (метал≥чний), фенолфталењн(1%-ний спиртовий розчин).
ќбладнанн€: прилад дл€ проведенн€ досл≥ду.
ѕеред початком досл≥ду необх≥дно ознайомитис€ з техн≥кою безпеки п≥д час роботи з метал≥чним натр≥Їм.
’≥д роботи
” суху проб≥рку приладу дл€ проведенн€ досл≥ду внос€ть 1мл абсолютного етилового спирту. ѕроб≥рку закр≥плюють у штатив≥, а пот≥м до спирту добавл€ють невеликий кусочок метал≥чного натр≥ю (розм≥ром €к четверта частина горошини), очищеного в≥д оксидного шару ≥ висушеного ф≥льтрувальним папером в≥д гасу. ѕроб≥рку закривають пр€мою газов≥дв≥дною трубкою з вит€гнутим к≥нцем.
—постер≥гають за активною взаЇмод≥Їю натр≥ю ≥з спиртом ≥ вид≥ленн€м газопод≥бного продукту (водню). „ерез хвилину в≥д початку реакц≥њ проб≥рку, не зн≥маючи з≥ штативу, обгортають куском тканини ≥ газ, €кий вид≥л€Їтьс€ з реакц≥йноњ сум≥ш≥, п≥дпалюють. √аз загораЇтьс€ (≥нод≥ ≥з звуком, характерним дл€ загор€нн€ сум≥ш≥ водню з пов≥тр€м Ц гримучий газ!) ≥ горить злегка голубуватим полумТ€м, характерним дл€ гор≥нн€ водню.
” процес≥ реакц≥њ утворюЇтьс€ також етилат натр≥ю, €кий ос≥даЇ на дно проб≥рки у вигл€д≥ осаду б≥лого кольору. ѕ≥сл€ того €к весь натр≥й ув≥йде в реакц≥ю (Ѕудьте уважн≥! ” проб≥рц≥ не повинно бути кусочк≥в метал≥чного натр≥ю!), до реакц≥йноњ сум≥ш≥ добавл€ють 1мл води. ≈тилат натр≥ю розчин€Їтьс€, пот≥м у реакц≥йну сум≥ш внос€ть к≥лька крапель 1%-ного спиртового розчину фенолфталењну. –еакц≥йна сум≥ш забарвлюЇтьс€ в малиновий кол≥р, що св≥дчить про утворенн€ лужного середовища. ≈тилат натр≥ю г≥дрол≥зуЇтьс€ (розкладаЇтьс€) водою, €ка маЇ сильн≥ш≥ кислотн≥ властивост≥, н≥ж етиловий спирт. ” цьому раз≥ утворюютьс€ етиловий спирт ≥ г≥дроксид натр≥ю.
 2Ќ3—Ц—Ќ2ЦќЌ + 2Nа 2—Ќ3Ц—Ќ2ЦќЦ Nа + Ќ2
2Ќ3—Ц—Ќ2ЦќЌ + 2Nа 2—Ќ3Ц—Ќ2ЦќЦ Nа + Ќ2
≈тилат натр≥ю
 Ќ3—Ц—Ќ2ЦќЦNа + ЌќЌ Ќ3—Ц—Ќ2ЦќЌ + NаќЌ
Ќ3—Ц—Ќ2ЦќЦNа + ЌќЌ Ќ3—Ц—Ќ2ЦќЌ + NаќЌ
ѕо€сн≥ть, чому натр≥й зам≥нюЇтьс€ на водень, €кий м≥ститьс€ б≥л€ атома ќксигену, а не б≥л€ атома арбону.
3) ƒобуванн€ диетилового еф≥ру / 4 / є 34 (ј), с. 50.
–еактиви: етиловий спирт (96%); кислота (концентрована); бромна вода (насичений розчин); перманганат кал≥ю (1%-й розчин); натр≥й (метал≥чний).
ќбладнанн€: прилад дл€ добуванн€ д≥етилового еф≥ру.
” суху проб≥рку внос€ть 1мл етилового спирту ≥ крапл€ми, пост≥йно перем≥шуючи, добавл€ють 1мл концентрованоњ сульфатноњ кислоти. ¬ одержану сум≥ш вкидають кипТ€тильн≥ кам≥нц≥ ≥ обережно нагр≥вають њњ до початку кип≥нн€. ѕ≥сл€ цього в гар€чу сум≥ш по ст≥нц≥ проб≥рки добавл€ють 10 крапель етилового спирту.
ƒ≥етиловий еф≥р, €кий утворюЇтьс€ при цьому, ви€вл€ють за запахом.
ѕ≥дпалюють д≥етиловий еф≥р поблизу отвору газов≥дв≥дноњ трубки ≥ спостер≥гають, пари еф≥ру гор€ть св≥тлим полумТ€м.
 Ќ3—Ц—Ќ2ЦќЌ + ЌќSќ3Ќ Ќ3—Ц—Ќ2ЦќЦSќ3Ќ + Ќ2ќ
Ќ3—Ц—Ќ2ЦќЌ + ЌќSќ3Ќ Ќ3—Ц—Ќ2ЦќЦSќ3Ќ + Ќ2ќ
≈тилсульфатна кислота
 Ќ3—Ц—Ќ2ЦќЦSќ3Ќ + Ќ3—Ц—Ќ2ЦќЌ Ќ3—Ц—Ќ2ЦќЦ—Ќ2Ц—Ќ3 + Ќ2Sќ4
Ќ3—Ц—Ќ2ЦќЦSќ3Ќ + Ќ3—Ц—Ќ2ЦќЌ Ќ3—Ц—Ќ2ЦќЦ—Ќ2Ц—Ќ3 + Ќ2Sќ4
ƒиетиловий еф≥р
4) ќкисненн€ етилового спирту / 4 / є 45 (Ѕ), с. 63
–еактиви: етиловий спирт (96%); фуксинс≥рчиста кислота (розчин); б≥хромат кал≥ю; с≥рчана кислота (10%-ний розчин).
ќбладнанн€: прилад дл€ добуванн€ оцтового альдег≥ду(м≥дна сп≥раль).
ќкисненн€ етилового спирту б≥хроматом кал≥ю.
” проб≥рку внос€ть 0,5г б≥хромату кал≥ю ≥ 2мл 10%-ного розчину сульфатноњ кислоти. ѕост≥йно перем≥шуючи реакц≥йну сум≥ш, поступово крапл€ми добавл€ють у нењ 2мл етилового спирту. —постер≥гають, €к роз≥гр≥ваЇтьс€ сум≥ш ≥ зм≥нюЇтьс€ њњ забарвленн€.
ќдержаний водний розчин оцтового альдег≥ду досл≥джують на на€вн≥сть альдег≥ду. ƒл€ цього до 1мл фуксинс≥рчистоњ кислоти добавл€ють 1мл одержаного водного розчину оцтового альдег≥ду. —постер≥гають, €к розчин фуксинс≥рчистоњ кислоти забарвлюЇтьс€ у рожево-ф≥олетовий кол≥р. ќтже, у проб≥рц≥-приймач≥ у водному розчин≥ м≥ститьс€ оцтовий альдег≥д. ќдержаний водний розчин оцтового альдег≥ду залишають дл€ проведенн€ реакц≥њ ср≥бного дзеркала ≥ реакц≥њ з купрум (≤≤) г≥дроксидом.
 O
O

 3Ќ3—Ц—Ќ2ЦќЌ+ 2—r2O7+ 4 H2SO4 3H3CЦC + K2SO4 + Cr2(SO4)3 +
3Ќ3—Ц—Ќ2ЦќЌ+ 2—r2O7+ 4 H2SO4 3H3CЦC + K2SO4 + Cr2(SO4)3 +
H + 7H2O
5) ¬заЇмод≥€ спирт≥в р≥зноњ атомност≥ з купрум (≤≤) г≥дроксидом / 4 / є 30, с. 45
–еактиви: етиловий спирт (96%); етиленгл≥коль; гл≥церин; (5%-й розчин); г≥дроксид натр≥ю (5%-й розчин).
ƒосл≥д провод€ть одночасно в трьох проб≥рках, у кожну з €ких внос€ть по 1мл 5%-ного розчину купрум (≤≤) сульфат ≥ 1мл 5%-ного розчину натр≥ю г≥дроксиду. ” проб≥рках утворюЇтьс€ осад купрум (≤≤) г≥дроксиду. ѕ≥сл€ цього в першу проб≥рку добавл€ють 1мл 96%-ного етилового спирту, у другу Ц 1мл етиленгл≥колю, у третю Ц 1мл гл≥церину. –еакц≥йн≥ сум≥ш≥ в проб≥рках перем≥шують. —постер≥гають, €к етиленгл≥коль ≥ гл≥церин розчин€ють купрум (≤≤) г≥дроксид ≥ розчини в друг≥й ≥ трет≥й проб≥рках забарвлюютьс€ в темно-син≥й кол≥р за рахунок утворенн€ розчинних у вод≥ комплексних сполук гл≥кол€ту ≥ гл≥церату купруму (≤≤). ≈тиловий спирт не розчин€Ї купру му (≤≤) г≥дроксид. ќтже, кислотн≥ властивост≥ дво- ≥ триатомних спирт≥в виражен≥ значно сильн≥ше, н≥ж одноатомних.
Ќ



 —Ќ2ЦќЌ —Ќ2Цќ: ќЦ—Ќ2
—Ќ2ЦќЌ —Ќ2Цќ: ќЦ—Ќ2
 2 + —u(ќЌ)2 —u + 2Ќ2ќ
2 + —u(ќЌ)2 —u + 2Ќ2ќ
 —Ќ2ЦќЌ —Ќ2Цќ: ќЦ—Ќ2
—Ќ2ЦќЌ —Ќ2Цќ: ќЦ—Ќ2
Ќ
√л≥кол€т купруму (≤≤)
Ќ
│

 —Ќ2ЦќЌ —Ќ2Цќ: ќЦ—Ќ2
—Ќ2ЦќЌ —Ќ2Цќ: ќЦ—Ќ2
│ │ │


 —ЌЦќЌ + —u(ќЌ)2 —ЌЦќЌ —u ЌќЦ—Ќ + 2Ќ2ќ
—ЌЦќЌ + —u(ќЌ)2 —ЌЦќЌ —u ЌќЦ—Ќ + 2Ќ2ќ
│ │ │
—Ќ2ЦќЌ —Ќ2Цќ: ќЦ—Ќ2
│
Ќ
√л≥церат купруму (≤≤)
–еакц≥€ з купрум (≤≤) г≥дроксидом Ї €к≥сною на багатоатомн≥ спирти. ѕо€сн≥ть, чому кислотн≥ властивост≥ дво- ≥ триатомних спирт≥в сильн≥ш≥, н≥ж одноатомних
6) ќдержанн€ етилового еф≥ру борноњ кислоти / 4 / є 33 (Ѕ), с. 49
” суху проб≥рку внос€ть 1г борноњ кислоти. ѕроб≥рку нагр≥вають у полумТњ пальника або спирт≥вки, тримаючи в горизонтальному положенн≥ так, щоб вода, €ка при цьому утворюЇтьс€, конденсуючись у крапл≥, не потрапл€ла на розжарен≥ ст≥нки проб≥рки (що може призвести до њх розтр≥скуванн€). Ѕорна кислота поступово плавитьс€. оли кристали зникнуть, проб≥рку охолоджують. ƒо прозорого твердого плаву (анг≥дриду борноњ кислоти) добавл€ють 2мл етилового спирту ≥ 1мл концентрованоњ сульфатноњ кислоти. ” проб≥рку внос€ть кипТ€тильн≥ кам≥нц≥ ≥ закривають њњ пр€мою газов≥дв≥дною трубкою з вит€гнутим к≥нцем. ѕроб≥рку з реакц≥йною сум≥шшю закр≥плюють в штатив≥ ≥ нагр≥вають у полумТњ. ѕари етилового еф≥ру борноњ кислоти, €к≥ при цьому утворюЇтьс€, п≥дпалюють поблизу отвору газов≥дв≥дноњ трубки. —постер≥гають гор≥нн€ етилборату полумТ€м з характерною смугою зеленого кольору.
t˚—
 2Ќ3¬ќ3 ¬2ќ3 + 3Ќ2ќ
2Ќ3¬ќ3 ¬2ќ3 + 3Ќ2ќ
t˚—
 ¬2ќ3 + 6C2Ќ5ќЌ 2(—2Ќ5ќ)3¬ + 3Ќ2ќ
¬2ќ3 + 6C2Ќ5ќЌ 2(—2Ќ5ќ)3¬ + 3Ќ2ќ
IV. ¬исновок зан€тт€
V. ƒомашнЇ завданн€
VI. Ћ≥тература:
1. ј.¬.ƒомбровський, ¬.ћ.Ќайдан. ќрган≥чна х≥м≥€. Ц .: ¬ища школа, 1992. с. 70 Ц 89
2. ‘.‘.ЅоЇчко, ¬.ћ.Ќайдан, ¬.ћ.«ахарик, Ќ.ћ.«ахарченко. ќрган≥чна х≥м≥€. .: ¬ища школа, 1986. с. 110 Ц 115
3. ј.ј.ѕетров, ’.¬.Ѕаль€н, ј.√. “рощенко. ќрганическа€ хими€. Цћ.: ¬ысша€ школа, 1981. с. 120 Ц 132
4. ¬.ћ.Ќайдан. ќрган≥чна х≥м≥€. ћалий лабораторний практикум. Ц .: ¬ища школа, 1994.
Ћабораторне зан€тт€ є 10
“ема: —пирти (јлканоли)
ћета: ¬ивчити будову, взаЇмний вплив атом≥в в молекул≥ спирт≥в. Ќа њх основ≥ вм≥ти по€снювати х≥м≥чн≥ властивост≥ одноатомних ≥ багатоатомних спирт≥в
I. онтрольна робота
II. “еоретичн≥ питанн€ теми:
1. ласиф≥кац≥€ спирт≥в. Ќавести приклади.
2.√омолог≥чний р€д спирт≥в.
3.≤зомер≥€, номенклатура спирт≥в.
4.≈лектронна будова спирт≥в.
5. ислотно-основн≥ властивост≥ спирт≥в.
6.’≥м≥чн≥ властивост≥ одноатомних, двохатомних ≥ трьохатомних спирт≥в на приклад≥ етилового спирту, етиленгл≥колю ≥ гл≥церину (реакц≥њ з метал≥чним Nа, NаќЌ, Ќ—l, –—l5, спиртами, карбоновими та м≥неральними кислотами, —u(ќЌ)2, окисненн€).
7.ќсновн≥ методи синтезу спирт≥в.
8.«наченн€ спирт≥в, б≥олог≥чна роль гл≥церину.
III. ¬исновок зан€тт€
IV. ƒомашнЇ завданн€
V. Ћ≥тература:
1. ј.¬.ƒомбровський, ¬.ћ.Ќайдан. ќрган≥чна х≥м≥€. Ц .: ¬ища школа, 1992. с. 70Ц89
2. ‘.‘.ЅоЇчко, ¬.ћ.Ќайдан, ¬.ћ.«ахарик, Ќ.ћ.«ахарченко. ќрган≥чна х≥м≥€. .: ¬ища школа, 1986. с. 110Ц115
3. ј.ј.ѕетров, ’.¬.Ѕаль€н, ј.√. “рощенко. ќрганическа€ хими€. Цћ.: ¬ысша€ школа, 1981. с. 120Ц132
Ћабораторне зан€тт€ є 11
“ема: ќдержанн€ ≥ х≥м≥чн≥ властивост≥ метаналю та етаналю
ћета: Ќавчитис€ добувати альдег≥ди окисненн€м спирт≥в, виконувати експерименти на п≥дтвердженн€ х≥м≥чних властивостей мурашиного та оцтового альдег≥д≥в
I. онтрольна робота
II. “еоретичн≥ питанн€ теми:
1. ’арактеристика альдег≥д≥в ≥ кетон≥в. Ќоменклатура альдег≥д≥в ≥ кетон≥в.
2. ћетоди синтезу мурашиного та оцтового альдег≥д≥в.
3. ’≥м≥чн≥ властивост≥ альдег≥д≥в /реакц≥њ з —u(ќЌ)2, реакц≥€ з ‘ел≥нговою р≥диною, реакц≥€ з ам≥акатом ср≥бла/.
4. –еакц≥€ альдег≥д≥в з фуксинс≥рчистою кислотою.
5. «астосуванн€ мурашиного та оцтового альдег≥д≥в.
6. ћетодика виконанн€ лабораторних досл≥д≥в.
III. Ћабораторн≥ досл≥ди
1) ƒобуванн€ мурашиного альдег≥ду окисненн€м метилового спирту / 4 / є44, с. 62
–еактиви: метиловий спирт; м≥дна дротинка, закручена з одного к≥нц€ в сп≥раль; фуксинс≥рчиста кислота (розчин).
ћ≥дну дротинку, один к≥нець €коњ впа€ний у скл€ну трубку, а другий закручений у сп≥раль, нагр≥вають у полумТњ до червоного кольору ≥ внос€ть у проб≥рку, в €ку попередньо наливають 1мл метилового спирту. ѕри цьому метанол закипаЇ, а м≥дна дротинка покриваЇтьс€ блискучим шаром метал≥чноњ м≥д≥. ƒосл≥д повторюють 3-4 рази. ѕ≥сл€ цього у проб≥рку добавл€ють 2-3мл розчину фуксинс≥рчистоњ кислоти. —постер≥гають, €к реакц≥йна сум≥ш забарвлюЇтьс€ у ф≥олетовий кол≥р. ќтже, у реакц≥йн≥й сум≥ш≥ в процес≥ окисненн€ метилового спирту утворивс€ мурашиний альдег≥д.
 ќ O
ќ O


 Ќ ЦЦ — + —uO ЌЦ— + —u + Ќ2ќ
Ќ ЦЦ — + —uO ЌЦ— + —u + Ќ2ќ
H Ќ
ћурашиний альдег≥д
2) ƒобуванн€ оцтового альдег≥ду окисненн€м етилового спирту / 4/ є 45, с.63
–еактиви: етиловий спирт (96%); фуксинс≥рчиста кислота (розчин); б≥хромат кал≥ю; сульфатна кислота (10%-й розчин).
ќбладнанн€: прилад дл€ добуванн€ оцтового альдег≥ду; м≥дна дротинка, закручена з одного боку в сп≥раль.
ј. ќкисненн€ етилового спирту купрум (≤≤) оксидом
ќкисненн€ етилового спирту ≥ ви€вленн€ оцтового альдег≥ду виконують аналог≥чно окисненню метилового спирту ≥ ви€вленню мурашиного альдег≥ду (досл≥д є 1). ƒл€ досл≥дженн€ зам≥сть метилового спирту беруть таку саму к≥льк≥сть етилового спирту.
 ќ
ќ

 Ќ3—Ц—Ќ2ЦќЌ + —uќ Ќ3—Ц— + —u + Ќ2ќ
Ќ3—Ц—Ќ2ЦќЌ + —uќ Ќ3—Ц— + —u + Ќ2ќ
Ќ
ќцтовий альдег≥д
Ѕ. ќкисненн€ етилового спирту б≥хроматом кал≥ю
” проб≥рку внос€ть 0,5г б≥хромату кал≥ю ≥ 2мл 10%-ного розчину сульфатноњ кислоти. ѕост≥йно перем≥шуючи реакц≥йну сум≥ш, поступово крапл€ми добавл€ють у нењ 2мл етилового спирту. —постер≥гають, €к роз≥гр≥ваЇтьс€ сум≥ш ≥ зм≥нюЇтьс€ њњ забарвленн€. ќдержаний водний розчин оцтового альдег≥ду досл≥джують на на€вн≥сть альдег≥ду. ƒл€ цього до 1мл фуксинс≥рчистоњ кислоти добавл€ють 1мл одержаного водного розчину оцтового альдег≥ду. —постер≥гають, €к розчин фуксинс≥рчистоњ кислоти забарвлюЇтьс€ в рожево-ф≥олетовий кол≥р. ќтже, у проб≥рц≥-приймач≥ у водному розчин≥ м≥ститьс€ оцтовий альдег≥д. ќдержаний водний розчин оцтового альдег≥ду залишають дл€ проведенн€ реакц≥њ ср≥бного дзеркала ≥ реакц≥њ з купрум (≤≤) г≥дроксидом
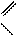 ќ
ќ
 3Ќ3—Ц—Ќ2ЦќЌ + 2—r2ќ7 + 4Ќ2Sќ4 3 Ќ3—Ц— + 2Sќ4 + —r2(Sќ4)3 +
3Ќ3—Ц—Ќ2ЦќЌ + 2—r2ќ7 + 4Ќ2Sќ4 3 Ќ3—Ц— + 2Sќ4 + —r2(Sќ4)3 +
Ќ
+ 7Ќ2ќ
3) –еакц≥€ альдег≥д≥в з —u(ќЌ)2 в лужному середовищ≥ / 4 / є 51, с. 69
–еактиви: формальдег≥д (40%-й розчин); купрум (≤≤) сульфат (2%-ний розчин); натр≥й г≥дроксиду (10%-ний розчин).
” проб≥рку внос€ть 1мл 2%-ного розчину купрум (≤≤) сульфату ≥ 10%-ного розчину натр≥й г≥дроксиду. ” проб≥рц≥ утворюЇтьс€ осад купрум (≤≤) г≥дроксиду. ѕ≥сл€ цього в проб≥рку добавл€ють 0,5-1мл 40%-ного розчину формальдег≥ду (формал≥ну). –еакц≥йну сум≥ш перем≥шують, а пот≥м нагр≥вають полумТ€м пальника або спирт≥вки до початку кип≥нн€ т≥льки верхню њњ частину так, щоб нижн€ частина залишилас€ дл€ контролю холодною. —постер≥гають у нагр≥т≥й частин≥ реакц≥йноњ сум≥ш≥ вид≥ленн€ купрум(≤) г≥дроксиду —uќЌ жовтого кольору, €кий пот≥м перетворюЇтьс€ на осад купрум (≤) оксиду —u2ќ червоного кольору. ≤нод≥ на ст≥нках проб≥рок вид≥л€Їтьс€ нав≥ть метал≥чна м≥дь. ќтже, альдег≥ди окиснюютьс€ купрум (≤≤) г≥дроксидом, в≥дновлюючи його до купрум г≥дроксиду або купрум (≤) оксиду –еакц≥€ в≥дновленн€ г≥дроксиду м≥д≥ (≤≤) Ї €к≥сною на альдег≥ди.
 —uSќ4 + 2NаќЌ —u(ќЌ)2 ↓ + Nа2Sќ4
—uSќ4 + 2NаќЌ —u(ќЌ)2 ↓ + Nа2Sќ4
√олубий
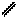
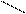 Ќ ќ
Ќ ќ


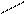 Ќ ЦЦ —ЦќЦЌ + —u(OЌ)2 ЌЦ— + 2—uќЌ↓ + Ќ2ќ
Ќ ЦЦ —ЦќЦЌ + —u(OЌ)2 ЌЦ— + 2—uќЌ↓ + Ќ2ќ
Ќ ќЌ жовтий
 2—uќЌ —u2ќ + Ќ2ќ
2—uќЌ —u2ќ + Ќ2ќ
червоний
4) –еакц≥€ альдег≥д≥в з ‘ел≥нговою р≥диною
¬ проб≥рку наливаЇмо 0,5мл розчину ‘ел≥нга ≤ ≥ добавл€Їмо до нього розчин ‘ел≥нга ≤≤, в так≥й к≥лькост≥, щоб осад, €кий утворивс€, розчинивс€. ƒо розчину доливаЇмо 0,5мл формал≥ну ≥ обережно нагр≥ваЇмо проб≥рку до початку кип≥нн€. —постер≥гаЇмо утворенн€ голубого кольору, €кий зм≥нюЇтьс€ на жовтий, а пот≥м на червоний.
ѕроходить окисно-в≥дновна реакц≥€. јльдег≥д окиснюЇтьс€ до карбоновоњ кислоти, а пот≥м —u(OH)2 в≥дновлюЇтьс€ до —u2O
5) –еакц≥€ Уср≥бного дзеркалаФ / 4 / є 50, с. 67
–еактиви: формал≥н (40%-й розчин); јргентум н≥трат (1%-й розчин); амон≥ю г≥дроксид (5%-ний розчин); натр≥ю г≥дроксид (10%-ний розчин).
ƒл€ одержанн€ Уср≥бного дзеркалаФ, спочатку потр≥бно добре вимити проб≥рки. ƒл€ цього кипТ€т€ть (обережно!) прот€гом 1-2хв по 5мл 10%-ного розчину натр≥й г≥дроксиду. ƒл€ р≥вном≥рного кип≥нн€ розчину лугу в нього вкладають к≥лька кипТ€тильних кам≥нц≥в. ѕот≥м розчин лугу виливають ≥ проб≥рки промивають дистильованою водою. ” вимиту проб≥рку внос€ть 1мл 1%-ного розчину јргентум н≥трату ≥ до нього доливають крапл€ми 5%-ний розчин амон≥й г≥дроксиду доти, поки осад јргентум г≥дроксиду, €кий спочатку утворюЇтьс€, не розчинитьс€ повн≥стю. Ќеобх≥дно стежити за тим, щоб у реакц≥йн≥й сум≥ш≥ не було надлишку ам≥аку, €кий знижуЇ чутлив≥сть реакц≥њ. ƒо одержаного безбарвного розчину јргентум ам≥акату в проб≥рку добавл€ють 0,5-1мл 40%-ного розчину формальдег≥ду. –еакц≥йну сум≥ш ставл€ть у вод€ну баню ≥ нагр≥вають к≥лька хвилин при температур≥ 60-70˚—. —постер≥гають поступове вид≥ленн€ на ст≥нках проб≥рок шару метал≥чного ср≥бла у вигл€д≥ дзеркала. ≤нод≥ ср≥бло вид≥л€Їтьс€ у вигл€д≥ темного осаду. ќтже, альдег≥ди легко окиснюютьс€ ≥ мають в≥дновн≥ властивост≥ (в≥дновлюють ср≥бло з його оксиду до метал≥чного стану).
 AgNO3 + NH4OH AgOH↓ + NH4NO3
AgNO3 + NH4OH AgOH↓ + NH4NO3
 2AgOH Ag2O + Ќ2ќ
2AgOH Ag2O + Ќ2ќ
 Ag2O + 4NH4OH 3[Ag(NЌ3)2]ќЌ + 3Ќ2ќ
Ag2O + 4NH4OH 3[Ag(NЌ3)2]ќЌ + 3Ќ2ќ
 ќ ќ
ќ ќ


 ЌЦ— + 2[Ag(NЌ3)2]ќЌ ЌЦ— + 2Ag↓ + 4NЌ3 + Ќ2ќ
ЌЦ— + 2[Ag(NЌ3)2]ќЌ ЌЦ— + 2Ag↓ + 4NЌ3 + Ќ2ќ
Ќ ќЌ
ћурашина кислота
 ќ ќ
ќ ќ


 ЌЦ— + NЌ3 ЌЦ—
ЌЦ— + NЌ3 ЌЦ—
ќЌ ќNЌ4
6) –еакц≥€ альдег≥д≥в з фуксинс≥рчистою кислотою / 4 / є 43 (ј), с. 60
–еактиви: формальдег≥д (10%-й розчин); оцтовий альдег≥д (10%-ний розчин); фуксинс≥рчиста кислота.
ƒосл≥д провод€ть у двох проб≥рках, в €к≥ внос€ть по 1мл фуксинс≥рчистоњ кислоти. ѕот≥м в одну добавл€ють 5 крапель 10%-ного розчину формальдег≥ду, а в ≥ншу Ц таку саму к≥льк≥сть 10%-ного оцтового альдег≥ду. ѕроб≥рки з реакц≥йними сум≥шами ставл€ть у штатив. —постер≥гають, €к через к≥лька хвилин розчин формальдег≥ду забарвлюЇтьс€ у ф≥олетовий кол≥р, а розчин оцтового альдег≥ду Ц у рожево-ф≥олетовий. –еакц≥€ з фуксинс≥рчистою кислотою дуже чутлива ≥ характерна дл€ альдег≥д≥в.
IV. ¬исновок зан€тт€
V. ƒомашнЇ завданн€
VI. Ћ≥тература:
1. ј.¬.ƒомбровський, ¬.ћ.Ќайдан. ќрган≥чна х≥м≥€. Ц .: ¬ища школа, 1992.с.162-182.
2. ‘.‘.ЅоЇчко, ¬.ћ.Ќайдан, ¬.ћ.«ахарик, Ќ.ћ.«ахарченко. ќрган≥чна х≥м≥€. .: ¬ища школа, 1986.с.142-156.
3. ј.ј.ѕетров, ’.¬.Ѕаль€н, ј.√. “рощенко. ќрганическа€ хими€. Цћ.: ¬ысша€ школа, 1981.с.151-169.
4. ¬.ћ.Ќайдан. ќрган≥чна х≥м≥€. ћалий лабораторний практикум. Ц .: ¬ища школа, 1994.
Ћабораторне зан€тт€ є 12
“ема: јльдег≥ди ≥ кетони
ћета: ¬ивчити будову, взаЇмний вплив атом≥в в молекул≥ альдег≥д≥в ≥ кетон≥в, реакц≥њ з участю карбон≥льноњ групи та вуглеводневого радикалу
I. онтрольна робота
II. “еоретичн≥ питанн€ теми:
1. √омолог≥чн≥ р€ди альдег≥д≥в ≥ кетон≥в.
2. ≤зомер≥€, номенклатура альдег≥д≥в ≥ кетон≥в.
3. ≈лектронна будова карбон≥льноњ групи (-≤, -ћ-ефекти, природа подв≥йного звТ€зку в груп≥ —=ќ).
4. ќсновн≥ методи синтезу альдег≥д≥в ≥ кетон≥в (дег≥друванн€ спирт≥в, п≥рол≥з кальц≥Ївих солей карбонових кислот, г≥дратац≥€ ацетиленових вуглеводн≥в Ц р. учерова, г≥дрол≥з дигалогеналкан≥в).
5. –еакц≥њ приЇднанн€ (приЇднанн€ Ќ—N, ћg-орган≥чних сполук, спирт≥в, ам≥аку ≥ його пох≥дних). ”ротроп≥н.
6. ќкисно-в≥дновн≥ реакц≥њ альдег≥д≥в ≥ кетон≥в.
7. –еакц≥њ зам≥щенн€ α-водневих атом≥в ≥ кисню карбон≥льноњ групи.
8. ѕол≥меризац≥€ альдег≥д≥в.
9. јльдольна ≥ кротонова конденсац≥њ.
10.«астосуванн€ альдег≥д≥в ≥ кетон≥в. ≤нсектициди.
III. ¬исновок зан€тт€
IV. ƒомашнЇ завданн€
V. Ћ≥тература:
1. ј.¬.ƒомбровський, ¬.ћ.Ќайдан. ќрган≥чна х≥м≥€. Ц .: ¬ища школа, 1992. с. 162Ц 182
2. ‘.‘.ЅоЇчко, ¬.ћ.Ќайдан, ¬.ћ.«ахарик, Ќ.ћ.«ахарченко. ќрган≥чна х≥м≥€. .: ¬ища школа, 1986. с. 142Ц156
3. ј.ј.ѕетров, ’.¬.Ѕаль€н, ј.√. “рощенко. ќрганическа€ хими€. Цћ.: ¬ысша€ школа, 1981. с. 151Ц169
Ћабораторне зан€тт€ є 13
“ема: ’≥м≥чн≥ властивост≥ мурашиноњ, оцтовоњ та олењновоњ кислот
ћета: Ќавчитис€ проводити досл≥ди на п≥дтвердженн€ х≥м≥чних властивостей карбонових кислот
I. “еоретичн≥ питанн€ теми:
1. ’арактеристика карбонових кислот. Ќавести приклади.
2. ласиф≥кац≥€ карбонових кислот. Ќавести приклади.
3. ’≥м≥чн≥ властивост≥ карбонових кислот на приклад≥ мурашиноњ та оцтовоњ кислот (дисоц≥ац≥€, окисненн€, утворенн€ складних етер≥в, розклад мурашиноњ кислоти, реакц≥њ з металами, оксидами, г≥дроксидами та сол€ми).
4. ’≥м≥чн≥ властивост≥ олењновоњ кислоти (бромуванн€, реакц≥€ з KMnO4, вид≥ленн€ кислоти ≥з мила, г≥дрол≥з мила).
II. онтрольна робота
III. ћетодика виконанн€ лабораторних досл≥д≥в
1) ѕор≥вн€нн€ сили карбонових ≥ м≥неральних кислот
–еактиви: 0,1н розчини кислот: мурашиноњ, оцтовоњ, масл€ноњ, стеариновоњ або пальм≥тиновоњ, сол€ноњ.
ќбладнанн€: ун≥версальний ≥ндикаторний пап≥рець з≥ шкалою рЌ.
Ќа смужку ун≥версального ≥ндикаторного пап≥рц€ нанос€ть по одн≥й крапл≥ 0,1н розчину кислот мурашиноњ, оцтовоњ, масл€ноњ, стеариновоњ або пальм≥тиновоњ, сол€ноњ. «а допомогою шкали визначають рЌ цих розчин≥в.
2) ¬заЇмод≥€ мурашиноњ кислоти з ам≥ачним розчином г≥дроксиду ср≥бла (реакц≥€ Уср≥бного дзеркалаФ)
–еактиви: 1% розчин н≥трату ср≥бла, 5% розчин ам≥аку, 80% розчин мурашиноњ кислоти.
” проб≥рку внос€ть 0.5 мл 1% -го розчину н≥трату ср≥бла ≥ до нього крапл€ми добавл€ють 5%-й розчин ам≥аку до полного розчиненн€ осаду г≥дроксиду ср≥бла, €кий спочатку утворивс€. ƒо приготовленого у такий спос≥б ам≥акату г≥дроксиду ср≥бла добавл€ють 0,5 мл 80%-њ мурашиноњ кислоти. –еакц≥йну сум≥ш злегка нагр≥вають. —постер≥гають утворенн€ осаду метал≥чного ср≥бла темно-с≥рого кольору. ќтже, мурашина кислота маЇ в≥дновн≥ властивост≥ ≥ даЇ реакц≥ю Уср≥бного дзеркалаФ, характерну дл€ альдег≥д≥в.
3) ќкисненн€ мурашиноњ кислоти перманганатом кал≥ю
–еактиви: 80% розчин мурашиноњ кислоти, 5% розчин перманганату кал≥ю, 10% розчин сульфатноњ кислоти, вапн€на вода.
ќбладнанн€: газов≥дв≥дна трубка.
” проб≥рку внос€ть 0,5 мл 80%-њ мурашиноњ кислоти, 2 мл 5%-го розчину перманганату кал≥ю≥ 0,5 мл 10%-го розчину сульфатноњ кислоти. ѕроб≥рку закривають пробкою з газов≥дв≥дною трубкою, к≥нець €коњ опускають у проб≥рку з 2 мл вапн€ноњ (баритовоњ) води. –еакц≥йну сум≥ш нагр≥вають. —постер≥гають њњ знебарвленн€ ≥ помутн≥нн€ вапн€ноњ (баритовоњ) води. ќтже, мурашина кислота легко окислюЇтьс€ до вуг≥льноњ кислоти, €ка, в свою чергу, розкладаЇтьс€ з утворенн€м оксиду вуглецю(IV) ≥ води.
4) ƒобуванн€ оцтовоњ кислоти з њњ солей
–еактиви: ацетат натр≥ю, концентрована сульфатна кислота.
” проб≥рку внос€ть 1г ацетату натр≥ю. «вертають увагу на те, що ацетат натр≥ю не маЇ запаху. ƒо внесеного в проб≥рку ацетату натр≥ю добавл€ють 1 мл концентрованоњ сульфатноњ кислоти. Ћегким помахом руки поблизу отвору проб≥рки встановлюють, що в реакц≥йн≥й сум≥ш≥ утворилась оцтова кислота, €ка маЇ запах оцту. /Ќюхати пари оцтовоњ кислоти обережно!/
5) ¬заЇмод≥€ оцтовоњ кислоти з карбонатом натр≥ю
–еактиви: 10% розчин карбонату натр≥ю, льод€на оцтова кислота, вапн€на вода.
ќбладнанн€: газов≥дв≥дна трубка.
” проб≥рку внос€ть 1 мл 10% розчину карбонату натр≥ю ≥ до нього обережно крапл€ми добалл€ють льод€ну оцтову кислоту. /ќбережно! ¬сп≥нюванн€!/ –еакц≥йну сум≥ш швидко закривають пробкою з газов≥дв≥дною трубкою, к≥нець €коњ опускають у проб≥рку з 2 мл вапн€ноњ /баритовоњ/ води. —постер≥гають вид≥ленн€ газопод≥бного продукту —ќ2 ≥ помутн≥нн€ вапн€ноњ /баритовоњ/ води. ќтже, оцтова кислота сильн≥ша за вуг≥льну ≥ вит≥сн€Ї њњ з карбонат≥в.
6) ¬≥дношенн€ оцтовоњ кислоти до д≥њ окислювач≥в
–еактиви: льод€на оцтова кислота, 1% розчин перманганату кал≥ю, 5% розчин сульфатноњ кислоти.
” проб≥рку внос€ть 0,5 мл льод€ноњ оцтовоњ кислоти, 2-3 мл 1%-го розчину перманганату кал≥ю ≥ 1 мл 5%-го розчину сульфатноњ кислоти. –еакц≥йну сум≥ш перем≥шують. —постер≥гають, що ф≥олетове забарвленн€ перманганату при цьому не зм≥нюЇтьс€. ќтже, оцтова кислота ст≥йка до д≥њ окислювач≥в.
7) √≥дрол≥з натр≥Ївих солей вищих карбонових кислот
–еактиви: спиртовий розчин мила, розчин фенолфталењну
” суху проб≥рку внос€ть 1мл спиртового розчину мила ≥ к≥лька крапель 1%-ного спиртового розчину фенолфталењну. ќдержують безбарвну реакц≥йну сум≥ш. ѕ≥сл€ цього до нењ пов≥льно добавл€ють крапл€ми воду. —постер≥гають забарвленн€ реакц≥йноњ сум≥ш≥ в малиновий кол≥р.
8) ¬ид≥ленн€ жирних кислот з мила.
–еактиви: мило (стружки), 10%-ний розчин с≥рчаноњ кислоти.
” проб≥рку внос€ть к≥лька стружок мила ≥ 1-2мл води. ѕри перем≥шуванн≥ скл€ною паличкою мило розчин€ють у вод≥. ƒо одержаного водного розчину мила добавл€ють 1-2мл 10%-ного розчину с≥рчаноњ кислоти. —постер≥гають утворенн€ осаду вищих карбонових кислот. –еакц≥йну сум≥ш нагр≥вають майже до кип≥нн€. ¬ищ≥ жирн≥ кислоти плавл€тьс€ ≥ спливають над реакц≥йною сум≥шшю у вигл€д≥ масл€нистого шару, €кий при охолодженн≥ стаЇ твердим. —кл€ною паличкою виймають цей твердий продукт, промивають його водою ≥ уважно розгл€дають.
”творенн€ нерозчинних солей вищих карбонових кислот
–еактиви: мило (водний розчин), 5%-ний розчин хлориду кальц≥ю.
” проб≥рку внос€ть 2мл водного розчину мила, добавл€ють 5-6 крапель 5%-ного розчину хлориду кальц≥ю. —постер≥гають утворенн€ нерозчинноњ сол≥ стеарату кальц≥ю.
10) ¬≥дношенн€ олењновоњ кислоти до бромноњ води ≥ розчину перманганату кал≥ю
–еактиви: олењнова кислота, бромна вода (насичений розчин), перманганат кал≥ю (1%-ний розчин).
” дв≥ проб≥рки внос€ть по 1мл бромноњ води та розчину перманганату кал≥ю а пот≥м добавл€ють по 2 крапл≥ олењновоњ кислоти в обидв≥ проб≥рки. –еакц≥йн≥ сум≥ш≥ енерг≥йно перем≥шують ≥ спостер≥гають знебарвленн€ розчин≥в в обох проб≥рках.
IV. ¬исновок зан€тт€
V. ƒомашнЇ завданн€
VI. Ћ≥тература:
1. ј.¬.ƒомбровський, ¬.ћ.Ќайдан. ќрган≥чна х≥м≥€. Ц .: ¬ища школа, 1992. с. 183Ц197
2. ‘.‘.ЅоЇчко, ¬.ћ.Ќайдан, ¬.ћ.«ахарик, Ќ.ћ.«ахарченко. ќрган≥чна х≥м≥€. .: ¬ища школа, 1986. с. 157Ц164
3. ј.ј.ѕетров, ’.¬.Ѕаль€н, ј.√. “рощенко. ќрганическа€ хими€. Цћ.: ¬ысша€ школа, 1981. с. 176Ц188
4. ¬.ћ.Ќайдан. ќрган≥чна х≥м≥€. ћалий лабораторний практикум. Ц .: ¬ища школа, 1994.
Ћабораторне зан€тт€ є 14
“ема: Ќасичен≥ ≥ ненасичен≥ карбонов≥ кислоти
ћета: закр≥пити, розширити ≥ поглибити знанн€ про класиф≥кац≥ю та властивост≥ карбонових кислот.
I. онтрольна робота
II. “еоретичн≥ питанн€ теми:
1. ’арактеристика карбонових кислот. ≤зомер≥€, номенклатура.
2. ласиф≥кац≥€ карбонових кислот. Ќавести приклади.
3. ≈лектронна будова карбоксильноњ групи.
4. ¬ищ≥ карбонов≥ кислоти (олењнова, стеаринова, пальм≥тинова), будова, х≥м≥чн≥ властивост≥.
5. ќсобливост≥ будови мурашиноњ кислоти, окисненн€ мурашиноњ кислоти. ’≥м≥чн≥ властивост≥ оцтовоњ кислоти.
6. ћило. √≥дрол≥з мила.
7. Ѕ≥олог≥чна роль карбонових кислот.
III. ¬исновок зан€тт€
IV. ƒомашнЇ завданн€
V. Ћ≥тература:
1. ј.¬.ƒомбровський, ¬.ћ.Ќайдан. ќрган≥чна х≥м≥€. Ц .: ¬ища школа, 1992. с. 183Ц197
2. ‘.‘.ЅоЇчко, ¬.ћ.Ќайдан, ¬.ћ.«ахарик, Ќ.ћ.«ахарченко. ќрган≥чна х≥м≥€. .: ¬ища школа, 1986. с. 157Ц164
3. ј.ј.ѕетров, ’.¬.Ѕаль€н, ј.√. “рощенко. ќрганическа€ хими€. Цћ.: ¬ысша€ школа, 1981. с. 176Ц188
4. ¬.ћ.Ќайдан. ќрган≥чна х≥м≥€. ћалий лабораторний практикум. Ц .: ¬ища школа, 1994.
Ћабораторне зан€тт€ є 15
“ема: ’≥м≥чн≥ властивост≥ сечовини
ћета: вм≥ти виконувати досл≥ди, €к≥ п≥дтверджують будову молекули сечовини та взаЇмний вплив атом≥в в молекул≥.
I. “еоретичн≥ питанн€ теми:
1. ’арактеристика пох≥дних карбонових кислот.
2. Ѕудова сечовини, взаЇмний вплив атом≥в в молекул≥.
3. ’≥м≥чн≥ властивост≥ сечовини:
а) утворенн€ б≥урету, доказ на€вност≥ в його молекул≥ пептидного (ам≥дного) звТ€зку;
б) г≥дрол≥з сечовини;
в) утворенн€ солей сечовини.
ћетодика виконанн€ лабораторних досл≥д≥в
1. ѕор≥вн€нн€ основних властивостей сечовини ≥ ам≥аку
–еактиви та обладнанн€: сечовина (20%-ний розчин); лакмусов≥ пап≥рц≥ (червоний ≥ син≥й).
” проб≥рку внос€ть 0,5г кристал≥чноњ сечовини ≥ 2мл води. Ќа смужки синього ≥ червоного лакмусового пап≥рц≥в нанос€ть по одн≥й крапл≥ одержаного розчину. —постер≥гають, що забпрвленн€ не зм≥нюЇтьс€. ќдночасно на лакмусов≥ пап≥рц≥ нанос€ть розчин ам≥аку ≥ перконуютьс€, що ам≥ак зм≥нюЇ забарвленн€ ≥ндикатора (червоний пап≥рець стаЇ син≥м).
”творенн€ солей сечовини
–еактиви та обладнанн€: сечовина (20%-ний розчин); н≥тратна кислота (концентрована), щавлева кислота (насичений розчин).
” дв≥ проб≥рки внос€ть по 1мл концентрованого розчину сечовини. ¬ одну проб≥рку добавл€ють к≥лька крапель концентрованоњ н≥тратноњ кислоти, а в другу Ц к≥лька крапель насиченого розчину щавлевоњ кислоти. ¬ обох проб≥рках випадають осади важкорозчинних солей сечовини Ц н≥трату сечовини та оксалату сечовини. «датн≥сть сечовини утворювати важкорозчинну с≥ль з н≥тратною кислотою використовують дл€ ви€вленн€ сечовини в розчинах.
3. √≥дрол≥з сечовини
–еактиви та обладнанн€: сечовина (20%-ний розчин); червоний лакмусовий пап≥рець, вапн€на вода; газов≥дв≥дна трубка, кипТ€тильн≥ кам≥нц≥.
” проб≥рку внос€ть 2мл 20%-ного розчину сечовини ≥ к≥лька кипТ€тильних кам≥нц≥в. ¬одний розчин сечовини нагр≥вають до кип≥нн€. ¬≥дчуваЇтьс€ р≥зкий запах ам≥аку, що вид≥л€Їтьс€ з реакц≥йноњ сум≥ш≥, на€вн≥сть €кого визначають змоченим водою червоним лакмусовим пап≥рцем, €кий п≥днос€ть до отвору проб≥рки. ≤ндикаторний пап≥рець стаЇ синього кольору.
ѕроб≥рку з реакц≥йною сум≥шшю закривають пробкою з газов≥дв≥дною трубкою, к≥нець €коњ опускають в проб≥рку з вапн€ною водою ≥ продовжують кипТ€тити. ѕомутн≥нн€ вапн€ноњ води св≥дчить про вид≥ленн€ карбон (≤V) оксиду.
4. ”творенн€ ≥з сечовини б≥урету
–еактиви ≥ обладнанн€: сечовина (кристал≥чна),г≥дрокид натр≥ю (10%-ний), сульфат м≥д≥ (1%-ний).
” сух≥й проб≥рц≥ нагр≥вають 0,2-0,3г сечовини. —ечовина спочатку плавитьс€ (tпл.= 133º—), а при подальшому нагр≥ванн≥ розкладаЇтьс€ з вид≥ленн€м ам≥аку. оли плав у проб≥рц≥ затвердне, нагр≥ванн€ припин€ють ≥ охолоджують проб≥рку, а до твердого залишку добавл€ють 2мл води ≥ дають в≥дсто€тис€. ѕот≥м розчин з осаду зливають в ≥ншу проб≥рку ≥ до одержаного б≥урету добавл€ють 5-6 крапель 10%-ного розчину лугу ≥ 1-2 крапл≥ 1%-ного сульфату м≥д≥. –озчин забпрвлюЇтьс€ в рожево-ф≥олетовий кол≥р. Ќадлишок сульфату м≥д≥ буде маскувати забарвленн€!
|
|
|
|
|
|
ƒата добавлени€: 2015-11-05; ћы поможем в написании ваших работ!; просмотров: 941 | Ќарушение авторских прав
Ћучшие изречени€:






