Мета: засвоїти метод пермангонатометрії; визначитиферум(ІІ) у розчині солі Мора 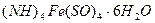
Знати: суть методу та основні прийоми окисно-відновного титрування
Вміти: грамотно виконувати титрування, проводити розрахунки за результатами титрування
Техніка безпеки: Бути уважним в хімічній лабораторії, проявляти обережність під час роботи з хімічними реактивами і хімічним посудом.
Суть методу: сіль Fe(II) у кислому середовищі титрується калій перманганатом; за кількістю використаного  обчислюється маса
обчислюється маса  у розчині солі Мора. Реакція між сіллю Мора і калій перманганатом у кислому середовищі проходить за рівнянням:
у розчині солі Мора. Реакція між сіллю Мора і калій перманганатом у кислому середовищі проходить за рівнянням:


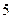


 г/моль
г/моль
1 

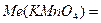 31,6 г/моль
31,6 г/моль
Хід роботи
1. Отримайте у викладача розчин для аналізу (“задачу”), який містить сіль Мора (мірна колба на 100мл). Об’єм розчину доведіть до позначки дистильованою водою і перемішайте.
2. У колбу для титрування перенесіть піпеткою 10мл “задачі”, додайте циліндром 10мл розчину  молярної концентрації еквіваленту 2 моль/л і відтитруйте стандартним розчином
молярної концентрації еквіваленту 2 моль/л і відтитруйте стандартним розчином  до рожевого кольору.
до рожевого кольору.
3. Титрування повторіть тричі, середнє значення об’єму  , що пішов на титрування, використайте для розрахунку концентрації титра солі Мора і маси ферум-йону
, що пішов на титрування, використайте для розрахунку концентрації титра солі Мора і маси ферум-йону  .
.
| № титрування | Розчин | |||
Робочий 
| Для аналізу 
| |||
| V, мл |  , моль/л , моль/л
| V, мл | С  , моль/л , моль/л
| |
| 10,00 | ||||
| 10,00 | ||||
| 10,00 | ||||
| середнє | 10,00 |
Формули для розрахунку


 мірної колби
мірної колби
Контрольні питання
1. Що лежить в основі методів окисно-відновного титрування?
2. Класифікація окисно-відновних методів?
3. В чому суть перманганатометричного титрування, концентрацію яких речовин можна визначити цим методом?
4. Яка маса калій перманганату потрібна для приготування 2-х літрів розчину молярної концентрації еквіваленту 0,02 моль/л?
5. Для визначення концентрації розчину калій перманганату необхідно приготувати 100 мл розчину натрій оксалату Na2C2O4 молярної концентрації еквіваленту С(1/2 Na2C2O4)=0,1 моль/л. Яку масу цієї солі потрібно зважити.
6. Яка маса KMnO4 потрібна для приготування 3 л розчину з титром Т=0,001616 г/мл
7. Наважку залізної проволки розчинили в сульфатній кислоті. На титрування цього розчину FeSO4 витратили 42,33 мл розчину KMnO4 молярної концентрації еквіваленту С(1/5 KMnO4) = 0,05795 моль/л. Визначити масу ферум (ІІ) в розчині.
8. Скласти схеми електронного балансу, урівняти коефіцієнти та розрахувати молярні маси еквівалентів окисників та відновників у наступних реакціях:
а) KMnO4 + KNO2 + H2SO4 → MnSO4 + K2SO4 + KNO3 +H2O
б)FeSO4+K2Cr2O7+H2SO4→Fe2(SO4)3+Cr2(SO4)3 +K2SO4+H2O
в) K2Cr2O7 + KI + H2SO4 → Cr2(SO4)3 + I2 + K2SO4 + H2O
г) KMnO4 + K2SO3 + KOH → K2MnO4 + K2SO4 + H2O
д) H3AsO3 + KMnO4+H2SO4 → H3AsO4 +MnSO4 +K2SO4+H2O
ж) Au + HNO3 + HCl → AuCl3 + NO + H2O
з) FeS + HNO3 → Fe(NO3)2 + S + NO + H2O






