Актуальність теми: Здатність розчинів електролітів проводити електричний струм широко використовується в біології і медицині для діагностики і в лікувальній справі. Знання закономірностей електропровідності різних електролітів залежить від різних факторів, можливість вимірювати опір розчинів за допомогою доступних вимірювальних приладів робить даний метод необхідним для професійної підготовки лікарів.
Навчальні цілі:
Знати: залежність електропровідності розчинів від природи і різних факторів, взаємозв’язок між різними видами електропровідності, ступенем дисоціації і константою дисоціації.
Вміти: визначити опір розчину, питому і молярну електропровідність, ступінь дисоціації і константу дисоціації через вимірювання опору розчинів електролітів.
Самостійна позааудиторна робота студентів.
1. Електропровідність. Провідники 1-го і 2-го роду.
2. Електропровідність розчинів сильних і слабких електролітів. Фактори, що впливають на електропровідність.
3. Питома і молярна (еквівалентна) електропровідність розчинів.
4. Електропровідність при безмежному розведенні. Гранична електропровідність. Закон Кольрауша.
5. Вимірювання електропровідності за допомогою електродної посудини. Постійна електродної посудини.
6. Розмірність питомої і молярної електропровідності та рухливості йонів.
7. Розрахунок ступеня і константи електролітичної дисоціації через електропровідність.
8. Електропровідність клітин і тканин, їх біомедичне значення.
Контрольні питання.
1. Електропровідність сильних і слабких електролітів.
2. Від яких факторів залежить електропровідність розчину?
3. Провідники 1-го і 2-го роду.
4. Постійна електродної посудини.
5. Що таке питома електропровідність?
6. Як змінюється питома електропровідність зі зміною концентрації розчинів сильних і слабких електролітів?
7. Що таке молярна електропровідність? Як зв’язані між собою питома і молярна електропровідність?
8. Як гранична еквівалентна електропровідність зв’язана з електричною рухливістю йонів?
9. Що таке гранична електропровідність? Закон Кольрауша.
10. Опір розчину AgNO3 з молярною концентрацією еквівалентів 0,1 моль/л при 298 К рівний 1090 Ом, а опір КСl з молярною концентрацією еквівалентів 0,02 моль/л в тій же електродній посудині при тих же умовах 4318 Ом, питома електропровідність його рівна 2,77.10-3 Ом-1.см-1. Розрахувати постійну електродної посудини, питому та еквівалентну електропровідність розчину AgNO3.
11. Питома електропровідність розчину пропіонової кислоти з концентрацією
С(1/1С2Н5СООН) = 7,8.10-3 моль/л дорівнює 1,21.10-4 Ом-1.см-1. Обчислити ступінь і константу дисоціації пропіонової кислоти.
Самостійна робота на занятті.
Виконати лабораторні роботи:
1. Визначити константу електродної посудини.
2. Визначити електропровідність розчинів слабих електролітів.
3. Визначити ступінь і константу дисоціації досліджуваних електролітів
Методика виконання роботи
Робота 1. Визначення константи електродної посудини.
Визначення константи електродної посудини проводять за допомогою розчину електроліту, для якого відоме значення питомої електропровідності. З цією метою використовують, як правило, 0,01 М розчин Ксl, для якого при 20 0С 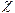 = 1,25 × 10-3 См/м.
= 1,25 × 10-3 См/м.
В посудину для визначення електропровідності наливають такий об’єм 0,01 М розчину Ксl, щоб електроди були повністю занурені в розчин. За допомогою омметра замірюють опір розчину в посудині і за формулою К = R× 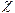 вираховують її константу.
вираховують її константу.
Робота 2. Визначення електропровідності розчинів слабих електролітів та біологічних рідин.
Визначивши постійну (константу) електродної посудини, останню старанно промивають дистильованою водою, наливають в неї відповідний досліджуваний розчин слабкого електроліту і вимірюють опір. Одержані дані заносять у таблицю:
| № п/п | Досліджуваний розчин | R | 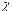
| 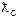
| 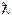 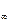
|
| 1 | 0,1 М НСООН | ||||
| 2. | 0,1 М СН3 СООН | ||||
| 3. | 0,1 М ССl3 COOH | ||||
| 4. | 0,1 М NH4 OH | ||||
| 5. | Шлунковий сік (1:10) | - | |||
| 6. | Сироватка крові (1:5) | - |
Використовуючи знайдені величини опору досліджуваних розчинів і постійну електродної посудини (K) розраховують питому електропровідність:
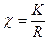
і молярну електропровідність:
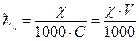 де:
де: 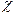 - питома електропровідність
- питома електропровідність
С - молярна концентрація
V – розведення, 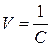
Для розчинів слабких електролітів розрахувати також граничну молярну електричну провідність, використовуючи дані довідника про електролітичну рухливість відповідних іонів:
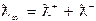
Результати занести в таблицю і зробити висновок.
Робота 3 .Порівняння сили електролітів на основі електропровідності їх розчинів.
Використовуючи дані із роботи № 2 про молярну електропровідність і граничну електропровідність відповідних розчинів електролітів, розраховують ступінь і константу дисоціації.
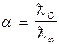 ; К=
; К= 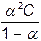
Дані занести у таблицю і зробити висновок про силу різних електролітів і як впливає введення хлору в радикал кислоти на її силу.
| № п/п | Досліджуваний розчин |  a a
| К |
| 1 | 0,1 М НСНОН | ||
| 2. | 0,1 М СН3 СООН | ||
| 3. | 0,1 М ССl3 COOH | ||
| 4. | 0,1 М NH4 OH |
Заняття №16






