Сукцинатдегидрогеназа (1.3.99.1.) катализирует окисление сукцината до фумарата. Кофактором фермента является ФАД - флавинадениндинуклеотид.
Реакция, катализируемая сукцинатдегидрогеназой, характеризуется абсолютной стереоспецифичностью элиминирования водорода, так что отщепляются исключительно атомы водорода в транс - положении. Если бы подобная специфичность не существовала, образовалась бы смесь (50:50) двух изомерных ненасыщенных дикарбоновых кислот; малеиновой (цис) и фумаровой (транс). Однако образуется только фумаровая кислота:

 FАD FАDН2
FАD FАDН2
| Н Н | НООС Н Н Н | |||
| ½ ½ | сукцинат- | \ / ½ ½ | ||
| НООС ¾С¾С¾СООН | ¾¾¾¾> | С= С + С = С | ||
| ½ ½ | <¾¾¾¾ | / \ ½ ½ | ||
| Н Н | дегидроге наза | Н СООН НООС СООН | ||
| фумаровая к-та малеинова к-та | ||||
| (транс) (цис) | ||||
| образуется не образуется |
é Цис и транс изомеры получились бы совместно,ù
ë если реакцияидет неспецифична û
Среди ферментов цикла лимоннонной кислоты сукцинатдегидрогеназа занимает особое место, поскольку локализована в митохондриальной мембране:
| О | ОН | |||||||
| || | | | |||||||
| С | С | |||||||
| / | \ | // | \ | |||||
| СI¾С | С¾СI | СI¾С | С¾СI | |||||
| || | || | | | || | |||||
| Н¾ С | С¾Н | Н¾ С | С¾Н | |||||
| \ | / | \\ | / | |||||
| СООН | С | СООН | С | |||||
| ½ | || | сукцинатдегидро- | ½ | | | ||||
| СН2 | + | N | ¾¾¾¾¾¾¾> | СН | + | N¾ Н | ||
| ½ | ½ | геназа (скелетной | || | ½ | ||||
| СН2 | С | мышцы) | СН | С | ||||
| ½ | // | \ | ½ | // | \ | |||
| СООН | Н¾ С | С¾ Н | СООН | Н¾ С | С¾ Н | |||
| | | || | | | || | |||||
| Н¾ С | С¾Н | Н¾ С | С¾Н | |||||
| \\ | / | \\ | / | |||||
| С | С | |||||||
| | | | | |||||||
| янтарная | ОNа | фумаровая | ОNа | |||||
| кислота | кислота | |||||||
окисленная форма восстановленная форма
(синий цвет) (бесцветная)
Принцип метода. В условиях опыта в качестве акцептора водорода при окислении сукцината используется 2,6 - дихлорфенолиндофенол, его натриевая соль.
В водном растворе окисленная форма 2,6 - дихлорфенолиндофенола окрашена в синий цвет. Восстановленная форма этого соединения - бесцветна. Активность сукцинатдегидрогеназы мышц обнаруживают, добавляя к мышечной кашице растворы янтарной кислоты и натриевой соли окисленной формы 2,6 - дихлорфенолиндофенола. Если сукцинатдегидрогеназа активна, интенсивность синей окраски ослабевается, благодаря бесцветной форме 2,6 - дихлорфенолиндофенола.
Ход работы. В две пробирки отмеривают по 3 мл фосфатного буфера с рН 7,4. В одну пробирку(опытную) добавляют 5 капель 5 %- ного раствора янтарной кислоты и (для нейтрализации) 5 капель 0,1 н. раствора едкого натра, в другую (контрольную) приливают 10 капель дистиллированной воды. В обе пробирки добавляют по 1 мл 0,001 н. раствора 2,6 - дихлорфенолиндофенола и по 50 мг хорошо измельченной мышечной ткани (свежей). Обе пробирки помещают на 20 мин. в термостат при 37 0С. Сравнивают интенсивность окрашивания в контрольной и опытной пробирках. Делают выводы и оформляют таблицу 2.
Таблица 2 - Основные параметры опыта и его результаты
| № опыта | Субстрат | Фермент | Тип катализируемой реакции | Условия проведения опыта (toС, рН, добавление др. реагентов) | Наблюдения |
Материалы и реактивы: экстракт мышечной ткани (см. Приложение В, п.3); фосфатный буфер, рН 7,4 (см. Приложение В, п.4); 5 % - ный раствор янтарной кислоты; 0,1 н. раствор NаОН; 0,001 н. раствор 2,6 - дихлорфенолиндофенола.
Оборудование: пробирки; пипетки; термостат.
Глюкозооксидаза (1.1.3.4)
Это двухкомпонентный фермент, содержащий в качестве простетической группы две молекулы флавинаденидинуклеотида (ФАД). Этот фермент катализирует дегидрирование глюкозы и перенос отнятого водорода на кислород воздуха с образованием пероксида водорода. При этом глюкоза превращается в глюконолактон:
| СН2ОН | СН2ОН | ||||
         Н ½ О ОН Н ½ О ОН
| Н ½ О | ||||
    Н Н
| + О2 | Н С = О | |||
    ОН Н ОН Н
| ¾¾¾¾¾¾> | ОН Н + | Н2О2 | ||
  НО Н НО Н
| НО | ||||
| Н ОН | Н ОН | ||||
| b - D- глюкопираноза b - глюконолактон |
В живых клетках и неочищенных ферментных препаратах, используемых в промышленности, глюкозооксидаза всегда присутствует с глюконолактоназой и каталазой, глюконолактон превращается в глюконовую кислоту:
| СН2ОН | СН2ОН | |
     Н ½ О Н ½ О
|    Н ½ ОН Н ½ ОН
| |
 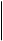      Н С = О Н С = О
| глюконолактоназа |    Н СООН Н СООН
|
   ОН Н +Н2О ОН Н +Н2О
| ОН Н | |
   НО НО
| НО | |
| Н ОН | Н ОН | |
| глюконолактон D - глюконовая кислота |
Пероксид водорода разлагается каталазой:
каталаза
2 Н2О2 ¾¾¾¾¾¾¾¾> 2 Н2О + О2
Так как очищенные препараты глюкозооксидазы взаимодействуют практически лишь с глюкозой, она является одним из важнейших ферментов, применяемых в пищевой технологии и клинической биохимии для определения сахара.
Глюкозооксидаза используется в пищевой промышленности как для удаления следов глюкозы, так и для удаления следов кислорода, при производстве сухого яичного порошка, пива, вина, соков, майонеза. Для удаления кислорода из продуктов, содержащих жир, упаковочный материал - синтетическую пленку - пропитывают глюкозооксидазой, глюкозой и буфером.






