ФЕРМЕНТЫ
ОКСИДОРЕДУКТАЗЫ
Методические указания к лабораторному практикуму
по дисциплине ”Биохимия"
для студентов специальностей Т.18.01., Т.18.02., Т.18.03.
Часть II. “Витамины и ферменты”
Могилев 2001
УДК 557.1
Рассмотрены и утверждены
на заседании кафедры ХТВМС
протокол № 10 от 18 мая 20001г.
Составители: доц. О.Н.Макасеева
асс. Л.М.Ткаченко
Рецензенты: проф. Г.Н. Роганов
доц. В.Н. Тимофеева
© Могилевский государственный технологический институт
Содержание
С
Введение.........................................................................................................4
1 НАД+- зависимые дегидрогеназы................................................................5
1.1 Использование неорганического фосфата в процессе брожения......6
1.2 Определение специфичности лактатдегидрогеназы............................8
2Флавиновые дегидрогеназы.........................................................................9
2.1 Качественное определение активности сукцинатдегидрогеназы....10
2.2Глюкозооксидаза (1.1.3.4)....................................................................12
2.3 Определение глюкозы с использованием фермента
глюкозоксиды..........................................................................................13
2.4 Открытие ксантиноксидазы в молоке.................................................14
3 Гемсодержащие ферменты - гемопротеины..........................................16 3.1Каталаза (1.11.1.6).................................................................................17
3.1.1 Обнаружение действие каталазы (качественно).............................17
3.1.2 Определение активности каталазы по А. Н. Баху и А.И.Опарину..............................................................................................18
3.2Пероксидаза (1.11.1.7)..........................................................................18
3.2.1 Обнаружение действия пероксидазы (качественно)......................19
Определение активности пероксидазы............................................20
4 Медь - содержащие оксидазы....................................................................21
4.1 Определение активности аскорбатоксидазы.....................................21
4.2 Полифенолоксидаза (1.14.18.1)...........................................................23
4.3 Обнаружение действия фенолоксидазы (качественно).....................24
4.4 Определение активности О–дифенолоксидазы
(полифенолоксидазы) и пероксидазы по Михлину и Броневицкой…..25
5 Список используемых источников...........................................................27
Приложение А...............................................................................................29
Приложение В............................................................................................30
Введение
К классу оксидоредуктаз относят ферменты, катализирующие окислительно–восстановительные реакции. Общая схема их может быть представлена следующим образом:
оксидоредуктаза
Субстрат + Акцептор ¾¾¾¾¾¾¾¾¾¾¾> Субстрат + Акцептор
АН2 В <¾¾¾¾¾¾¾¾¾¾¾ А ВН2
Характерной особенностью деятельности оксидоредуктаз в живой клетке является их способность образовывать системы (так называемые цепи окислительно–восстановительных ферментов), в которых осуществляется многоступенчатый перенос атомов водорода или электронов от первичного субстрата к конечному акцептору, которым является, как правило, кислород, так что в результате образуется вода.
Другая особенность оксидоредуктаз состоит в том, что, будучи двухкомпонентными ферментами с весьма ограниченным набором активных групп (коферментов), они способны ускорять большое число самых разнообразных окислительно–восстановительных реакций. Это достигается за счет того, что один и тот же кофермент способен соединяться со многими апоферментами (белками), образуя каждый раз оксидоредуктазу, специфическую по отношению к тому или иному субстрату или акцептору.
Еще одна, пожалуй, главная особенность оксидоредуктаз заключается в том, что они ускоряют протекание химических процессов, связанных с высвобождением энергии. Последняя используется как для обеспечения синтетических процессов в организме, так и для других нужд.
Оксидоредуктазы, которые переносят атомы водорода или электроны непосредственно на кислородные атомы, носят название аэробных дегидрогеназ или оксидаз. В отличии от них оксидоредуктазы, переносящие атомы Н или электроны от одного компонента окислительной цепи ферментов к другому без передачи их на кислородные атомы, называют анаэробными дегидрогеназами или редуктазами.
Подклассы оксидоредуктаз определяются типами соединений, выступающих в качестве доноров электронов. Например, ферменты подкласса 1 катализируют окисление гидроксигрупп до карбонильных, подкласса 2 - окисление карбонильных до карбоксильных и т.д.
В отдельные подклассы выделены ферменты (оксигеназы), катализирующие реакции введения атомов кислорода - одного, подкласс 14 (монооксигеназы) - двух, подкласс 13 (диоксигеназы) из молекулы О2.
В данном методическом указании рассмотрены более подробно строение и механизм действия оксидоредуктаз, имеющих важное значение в процессах технологической переработки пищевого сырья и при его хранении. Не менее важна роль этих ферментов в процессах дыхания живых организмов, окисления органических соединений - углеводов, липидов, белков, снабжающих клетку энергией.
1 НАД+- зависимые дегидрогеназы
Ферменты, катализирующие реакции окисления-восстановления с участием никотинамидадениндинуклеотида (НАД+), или его близкого аналога - никотинамидадениндинуклеотидфосфата (НАДФ+).
Более половины известных в настоящее время оксидоредуктаз содержат НАД+ или НАДФ+ в качестве кофермента, т.е являются двухкомпонентными, их называют пиридинпротеином. Пиридинпротеины способны отнимать от субстратов (спирты, альдегиды, кетокислоты, амины и др.) и включать в молекулу НАД+ (НАДФ+) 2 электрона и один протон (гидрид ион Н-) (окисляя, таким образом, указанные соединения, а второй протон остается в среде, в результате чего утрачивается положительный заряд пиридинового цикла НАД+ (НАДФ+):
| Н | Н Н | |
| ½ | \ / | |
| С O | С O | |
| // \ // | / \ // | |
| Н¾ С C ¾С- NH2 | Н¾ С C ¾С- NH2 | |
| ½ | | | | | | | | |
| Н¾- С C- Н | Н¾- С C- Н | |
| О \\ + / | О \ / | |
| || N | || N | |
       НО-Р- О-СН2 О НО-Р- О-СН2 О
| НО-Р- О-СН2 О | |
  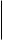   ½ NН2 +2Н ½ NН2 +2Н
| ½ NН2 | |
 ½ Н Н ½ ½ Н Н ½
| ½ Н Н ½ | |
  О Н ½ ½ Н N C [ 2Н+,2е; О Н ½ ½ Н N C [ 2Н+,2е;
| Н-, Н+] | О Н ½ ½ Н N C |
| ½ НО НО // \ / \\ | ½ НО НО // \ / \\ | |
| НО-Р= О Н-C C N | НО-Р= О Н- C C N | |
| ½ ½ || ½ | ½ ½ || ½ | |
      О-¾ СН2 О N¾¾C CН О-¾ СН2 О N¾¾C CН
| О -¾ СН2 О N¾¾C CН | |
    ½ \ // ½ \ //
| ½ \ // | |
| ½ Н Н N | ½ Н Н N | |
  Н ½ ½ Н Н3РО4 Н ½ ½ Н Н3РО4
| Н ½ ½ Н Н3РО4 | |
  НО О(Н) НО О(Н)
| НО О(Н) |
НАД+ (НАДФ+ ) НАДН (НАДФН)
Все пиридинпротеины являются анаэробными дегидрогеназами, т.е не передают снятые с субстрата атомы водорода на кислород, а передают их на ближайший в окислительной цепи другой фермент, как правило, флавопротеид.
Кофермент НАДФ+ является производным НАД+, у которого водород ОН - группы 2-го углеродного атома рибозы аденозина замещен на остаток фосфорной кислоты. Механизм окисления (своих субстратов) при участии НАДФ+ в качестве кофермента аналогичен таковому при посредстве НАД+.
Несмотря на то, что реакции, катализируемые НАД+ и НАДФ+ зависимыми ферментами - дегидрогеназами обратимы, их биологическое значение в большинстве случаев связано, преимущественно, с протеканием реакции в определенном направлении. При этом отчетливо проявляется такая закономерность: если биологически значимо окисление субстрата, то в реакции в качестве окислителя чаще всего участвуют НАД+ . Если же реакция этого подкласса имеет значение для восстановления какого - либо органического соединения, то чаще всего восстановителем является НАДФН.
Использование неорганического фосфата в процессе брожения
Процессы диссимиляции углеводов в растительных организмах, микроорганизмах, а также в организмах животных и человека как в анаэробных, так и в аэробных условиях протекают с участием неорганического фосфата.
Молекула фосфорной кислоты включается на стадии окисления 3 –фосфоглицеринового альдегида в 1,3–дифосфоглицериновую кислоту при участии НАД+ зависимой глицеральдегидфосфатдегидрогеназы.
| О | О | ||||
| / / | / / | ||||
| С¾ Н | + | глицеральдегид- | С¾О ~ (Р) | + | |
| ½ | + НАД | + Н3РО4 | ¾¾¾¾¾¾¾> | ½ + | НАДН+Н |
| Н¾С¾ОН | фосфатдегидро- | Н¾С¾ОН | |||
| ½ | геназа | ½ | |||
| СН2 ¾О(Р) | СН2 ¾О(Р) |
3- фосфоглицериновый 1,3 - дифосфоглицериновая
альдегид кислота
1,3–дифосфоглицериновая кислота представляет собой высокоэнергетическое соединение (макроэргическая связь условно обозначена значком ~ “тильда”). Далее происходит передача богатого энергией фосфатного остатка на АДФ с образованием АТФ и 3 - фосфоглицериновой кислоты:
| О | О | ||||
| / / | +2 | / / | |||
| С¾ О ~ (Р) | Мg | С ¾ ОН | |||
| ½ | + АДФ | ¾¾¾¾¾¾¾> | ½ + АТФ | ||
| Н¾С¾ ОН ½ СН2 ¾О-(Р) | <¾¾¾¾¾¾¾¾¾¾¾ фосфоглицераткиназа | Н¾С¾ОН ½ СН2¾О-(Р) |
1,3 - дифосфоглицериновая 3 - фосфоглицериновая
кислота кислота
АТФ участвует в фосфорилировании углеводов - в образовании метаболически активных форм сахаров - их фосфорных эфиров, например, из глюкозы путем фосфорилирования образуется глюкозо–6–фосфат под действием фермента гексокиназы:
Мg2+
АТФ + L-D-глюкоза ¾¾¾¾¾> АДФ + L-D-глюкоза- 6 - фосфат
гексокиназа
Глюкозо–6–фосфат превращается во фруктозо–6–фосфат под действием фермента фосфоглюкоизомеразы. Далее фруктозо–6–фосфат фосфорилируется при участии еще одной молекулы АТФ и фермента фосфофруктокиназы во фруктозо–1,6–дифосфат.
Принцип метода. Если в начале брожения и в процессе взять одинаковые пробы и проделать качественную реакцию (молибденовую) на фосфорную кислоту, то окажется,что интенсивность образующейся синей окраски в пробах убывает от первой к последней. Это обусловлено тем, что неорганический фосфат постепенно поглощается и количество его в среде уменьшается.
Количество же связанного фосфата в органической форме (АТФ, глюкозо–6–фосфат, фруктозо–6–фосфат и др.) увеличивается. Если пробы подвергнуть гидролизу, то органические соединения фосфора разрушаются и количество неорганического фосфата во всех пробирках будет равно начальной величине – окраска в пробирках будет одинаковой.
Химизм молибденовой реакции на фосфорную кислоту заключается в образовании комплексного соединения 12 молибдофосфата аммония (осадок желтого цвета), которое при добавлении аскорбиновой кислоты восстанавливается с образованием молибденовой сини (смесь окислов молибдена).
Молибденовая реакция на фосфорную кислоту:
РО4–3+ 3 NH4++ 12 МоО4–2 + 24 Н+¾® (NH4)3РО4 . 12 МоО3 + 12 Н2О
Ход работы. В четыре пронумерованные пробирки наливают по 1 мл 10 % раствора трихлоруксусной кислоты (ТХУ). В ступке растирают 1 г отмытых и отделенных на воронке Бюхнера дрожжей с 1 г глюкозы или сахарозы и 5 мл дистиллированной воды. К смеси добавляют 5 мл раствора фосфорнокислых солей, перемешивают и 1 мл смеси переносят в первую пробирку с ТХУ. При этом осаждаются белки, инактивируются ферменты и прекращается брожение.
Оставшуюся смесь переносят в высокий стаканчик и помещают в термостат при 37 °С на 1,5 часа. Через каждые 0,5 часа от начала брожения отбирают из стаканчика по 1 мл бродящей смеси в три пробирки с ТХУ. Через 5 минут после взятия последней пробы содержимое пробирок фильтруют через складчатые фильтры в 4 пронумерованные колбочки и получают безбелковые фильтраты.
В четыре чистые пробирки отбирают по 0,5 мл безбелкового фильтрата из колбочек и проводят молибденовую реакцию на фосфорную кислоту. Для этого в каждую пробирку вносят по 0,1 мл 2,5 % – ного раствора молибденовокислого аммония в серной кислоте и 0,5 мл 0,5 %–ного раствора аскорбиновой кислоты, перемешивают и оставляют на 15 минут. Затем в каждую пробирку добавляют по 8 мл дистиллированной воды, перемешивают и сравнивают окраску жидкости во всех пробирках. Интенсивность окраски должна уменьшаться от первой к четвертой пробирке, так как неорганический фосфат в процессе брожения убывает.
Для гидролиза образовавшихся органических соединений фосфора в четыре пронумерованные пробирки (второй ряд) вносят из колбочек по 0,5 мл безбелкового фильтрата и добавляют по 0,5 мл 2 н. раствора соляной кислоты и ставят в кипящую водяную баню на 8–10 минут. По окончании гидролиза во всех пробирках проделывают молибденовую реакцию.
Результаты работы заносят в таблицу 1, изображая интенсивность окраски знаками +1; +2; +3; +4.
Таблица 1 – Интенсивность окраски молибденовой реакции
В процессе брожения
| Показатели | № пробирок и время взятия проб | |||
| до брожения | через 30 минут | через 60 минут | через 90 минут | |
| Реакция на ионы РО4-3 до гидролиза | ||||
| Реакция на ионы РО4-3 после гидролиза органических соединений фосфора |
Материалы и реактивы: дрожжи; 10 %–ный раствор трихлоруксусной кислоты; глюкоза или сахароза; фосфорнокислые соли, раствор (см. Приложение В,п.1); молибденовый аммоний, 2,5 % раствор в 10 % растворе серной кислоты; 0,5 %–ный раствор аскорбиновой кислоты; 2 н. раствор соляной кислоты.
Оборудование: фарфоровые ступки; пробирки; пипетки на 1 мл; колбы; термостат; водяная баня.






