
В радикале основных дополнительно содержится аминогруппа, положительно заряжена:
Лизин (лиз)

Если же радикал не полярный (—СН2ОН), то заряд молекулы равен нулю:
Серин (сер)

Любые сдвиги рН среды приводят к изменению заряда молекулы. Та величина показателя, при которой значение общего заряда а/к стремится к нулю называется изоэлектрической точкой (ИЭТ, рІ). В ИЭТ их растворимость минимальна и кислота выпадает в осадок:
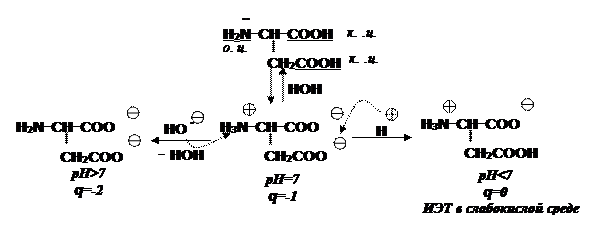
Особенностью a- аминокислот является их способность взаимодействовать друг с другом, с образованием пептидов:
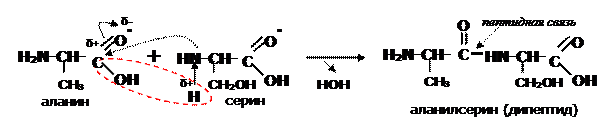
Между аминокислотами образуется новая связь – пептидная (амидная), довольно прочная, химически устойчива, в том числе к гидролизу. Поэтому белки в нормальных условиях подвергаются этой реакции только в присутствии кислого или щелочного катализатора при длительном кипячении:
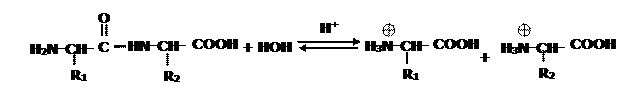
Гораздо быстрее протекает ферментативный гидролиз, продуктами которого являются соли аминокислот.
Количество мономеров в пептидах может сильно варьировать. Цепь, состоящая из двух аминокислот – дипептид, трёх – трипептид, из нескольких – олигопептид (olygo - мало), из большого числа – полипептид (Рис.1).

Простейшими представителями подобных соединений являются дипептиды. Примером могут служить: карнозин (от лат. carnosus -мясной) и ансерин. Они находятся в митохондриях, предотвращая их набухание, тем самым способствуют сохранению функций субклеточных образований.
Пептиды, включающие до 10 аминокислот, называются олигопептидами. Число звеньев в молекуле отражается в его названии: трипептид, пентапептид и т.д. Например: трипептид – глутатион, один из важнейших восстановителей в антиоксидантной системе организма, которая регулирует свободно-радикальные процессы.
Вазопрессин и окситоцин - гормоны задней доли гипофиза, состоят из 9 а/к. Регулируют баланс ионов в организме. Вазопрессин (антидиуретический гормон, АДГ) – усиливает реабсорбцию воды в почках, контролирует осмотическое давление плазмы крови и водный баланс. Служит гормоном верности и моногамности. А окситоцин вызывает сокращение гладких мышц матки и в меньшей степени − мышц мочевого пузыря и кишечника, стимулирует отделение молока молочными железами. Его ещё называют гормоном счастья, нежности.
Пептиды, содержащие более 10 а/к, называют полипептидами. Например: АКТГ - гормон передней доли гипофиза, состоит из 39 аминокислот. Стимулирует секрецию глюкокортикостероидов корой надпочечников; способствует обучению; обеспечивает долговременную память, улучшает адаптацию к изменяющимся условиям окружающей среды.
Пептиды - полярные молекулы и находятся в ионизированном состоянии, следовательно, имеют заряд и способны изменять его при сдвиге рН среды.
|

|

|

|
|

|

|


|



|
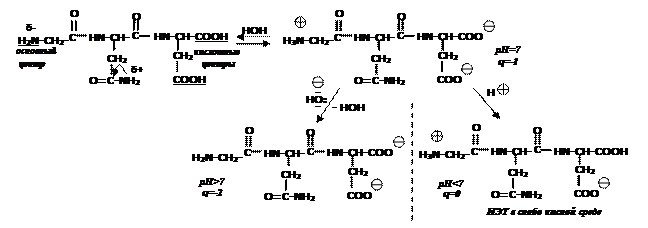
Полипептиды, включающие более чем 50 аминокислотных остатков, называют белками. Их многообразие обусловлено различным сочетанием ≈ 20-ти аминокислот.
Полипептидные цепи – это длинные нити, обеспечивающие выполнение определённых функций. За счёт чередования sp2 и sp3 гибридизованных атомов углерода они способны образовывать определённые более компактные формы молекул в пространстве – структуры белка. Различают четыре уровня подобной организации протеинов: первичную, вторичную, третичную и четвертичную структуры.
Существуют общие правила формирования пространственных структур молекул.
Первичная структура белка
Это генетически запрограммированная последовательность a-аминокислот L-ряда в полипептидной цепи. Она имеет зигзагообразное конформационное строение:

Стабилизируется с помощью пептидных связей.
Каждый белок организма имеет уникальную последовательность аминокислот.
Биороль данной структуры: специфические особенности чередования различных по строению а/к обуславливают индивидуализацию формирования пространственных структур (вторичной, третичной и четвертичной), а следовательно и свойства и функции получившегося протеина.
Варианты вторичной структуры белка
Данный уровень образуется благодаря вращению пептидных групп относительно друг друга или появлению в полипептидной цепи пролина, одноимённо заряженных либо крупных радикалов.
 Различают a-спираль и β-складчатый слой. Радикалы этих структур, как гидрофобные, так и гидрофильные, направлены наружу, т.к. наиболее выгодное расположение заместителей - транс-конформация, поэтому белки, имеющие лишь вторичную структуру, плохо растворимы в воде.
Различают a-спираль и β-складчатый слой. Радикалы этих структур, как гидрофобные, так и гидрофильные, направлены наружу, т.к. наиболее выгодное расположение заместителей - транс-конформация, поэтому белки, имеющие лишь вторичную структуру, плохо растворимы в воде.
Правозакрученная α-спираль (Рис.2) содержит 3,6 аминокислотных остатка в одном витке, это создает возможность для взаимодействия карбонильного атома кислорода одной пептидной группы с атомом водорода аминогруппы соседнего витка. В результате возникают многочисленные водородные связи, которые стабилизируют данную структуру.
β-структура представляет складчатый слой, образованный одной или несколькими полипептидными цепями, располагающимися параллельно или антипараллельно (Рис.3).
Эта пространственная организация молекулы похожа на «вытянутую» спираль, где радикалы аминокислот препятствуют спирализации и увеличивают расстояние между витками (одноименно заряженные или крупные радикалы).

Стабилизируются также за счёт водородных связей, а β-складчатый слой может и с помощью дисульфидных мостиков.
Биороль данной структуры: отвечает за формирование третичной структуры и свойства белка.
Третичная структура белка
Чередование α-спирализованных, β-структурированных и аморфных неспирализованных участков позволяет полипептидной цепи более плотно уложиться в пространстве. В разных белках наблюдается различное соотношение типов структур (Рис.3). Например, инсулин содержит 52% α-спирали и 6% β-структуры, трипсин – 14% и 45% соответственно. 
Первичная структура малоорганизованных участков включает пролин, особое строение которого, формирует в цепи изгибы. Формирование глобул происходит в водной среде клетки, поэтому гидрофобные радикалы аминокислот «прячутся» внутрь сферы, образуя «жирную» каплю, а гидрофильные – будут направлены наружу, способствуя созданию гидратной оболочки мицеллы. Поэтому подобные белки хорошо растворимы в воде.
Стабилизируется с помощью различных дополнительных (добавочных) связей, например:
· водородные – между —ОН, —СООН, —NH2 группами радикалов аминокислот;
· дисульфидные – между остатками цистеина;
· гидрофобные – между радикалами алифатических и ароматических аминокислот;
· ионные – между группами —СОО– глутамата или аспартата и —NH3+ группами лизина или аргинина;
· псевдопептидные – между дополнительными —СОО– группами глутамата или аспартата и дополнительными —NH3+ группами лизина или аргинина;
· эфирные – между гидроксигруппами треонина и серина (простые) или карбоксильной группой (—СООН) аспартата, глутамата и –ОН гидроксикислот (сложноэфирная).
Биороль: способствует формированию четвертичной структуры, обуславливает выполнение функций.
1.4. Четвертичная структура белка – высший уровень организации
Если глобулы состоят из двухиболее полипептидных цепей, объединённых между собой нековалентными (непептидными и недисульфидными) связями, то это свидетельствует, что они обладают четвертичной структурой. Подобные белки называются олигомерами, а их индивидуальные цепи – протомерами (мономерами, субъединицами). Если их молекулы содержат 2 протомера, то они называются димерами, если 4, то тетрамерами и т.д. Их число всегда чётное (от 2 до 24).
Например, гемоглобин А (HbА) – белок эритроцитов, связывающий кислород, состоит из четырёх субъединиц – 2 α- и 2 β-субъединицы (Рис.5). Лактатдегидрогеназа (ЛДГ) – фермент, принимающий активное участие в окислении глюкозы при мышечном сокращении, также включает 4  субъединицы – Н (heart) и М (muscle) в разных сочетаниях: Н4, Н3М1, Н2М2, Н1М3, М4. Креатинкиназа – энзим, участвующий в регенерации АТФ при мышечном сокращении, имеет только две субъединицы – В (brain) и М (muscle) в разных сочетаниях: ВВ, ВМ или ММ. Взаимодействие протомеров друг с другом осуществляется по принципу комплементарности, т.е. их поверхность подходит друг другу по геометрической форме и по функциональным группам аминокислот (возникновение ионных и водородных связей).
субъединицы – Н (heart) и М (muscle) в разных сочетаниях: Н4, Н3М1, Н2М2, Н1М3, М4. Креатинкиназа – энзим, участвующий в регенерации АТФ при мышечном сокращении, имеет только две субъединицы – В (brain) и М (muscle) в разных сочетаниях: ВВ, ВМ или ММ. Взаимодействие протомеров друг с другом осуществляется по принципу комплементарности, т.е. их поверхность подходит друг другу по геометрической форме и по функциональным группам аминокислот (возникновение ионных и водородных связей).
Стабилизируется с помощью добавочных связей.
Биороль: отвечает за проявление специфических функций белка, выполнение которых обеспечивает только мультимер; его распад приводит к снижению или потере активности протеина.
Особенности строения обуславливают свойства белков.
СВОЙСТВА ПРОТЕИНОВ






