Насыщенные растворы, находящиеся в равновесии с осадком, относятся к сложным гетерогенным системам, состоящим из нескольких фаз разного состава, соприкасающихся поверхностями раздела. Такая система содержит несколько компонентов, являющихся индивидуальными веществами, способными к самостоятельному существованию вне ее. Если между фазами устанавливается равновесие, то его называют фазовым. В насыщенном растворе малорастворимого соединения насыщенный раствор и твердая фаза (напр. кристаллы соли) находятся в равновесии. Такое равновесие называется динамическим, скорости растворения и осаждения равны между собой. В химическом анализе большое значение имеют двухкомпонентные (двухфазные) системы, состоящие из малорастворимого вещества (твердой фазы называемой осадком) и его насыщенного раствора (жидкой фазы).
Пусть дано малорастворимое соединение КmAn, состоящее из m катионов и n анионов. КmAn Û mKn+ + nAm-
Кд =  ; Кд [КmAn] = [Kn+]m[Am-]n
; Кд [КmAn] = [Kn+]m[Am-]n
В предположении, что растворимая форма полностью диссоциирует, тогда
Кд [КmAn] представляет собой концентрацию твердой фазы или осадка, а это постоянная величина, поэтому Кд [КmAn] = const. Т.о. При постоянной температуре и давлении произведение активностей (концентраций) ионов малорастворимого соединения в степени их стехиометрических коэффициентов в насыщенном растворе есть постоянная величина, называется произведением растворимости малорастворимого вещества, обозначается ПР, Кs, чаще – Lp. Lp для конкретной соли при данных условиях – величина постоянная, занесенная в справочные таблицы.
Произведение растворимости малорастворимого соединения КmAn вычисляется по формуле:
Lp(КmAn) = [Kn+]m[Am-]n
Часто вместо концентраций для сильных электролитов берут активности (если С¹а). Lp(КmAn) = а m(Kn+)× а n(Am-)
Но если в растворе плохорастворимого соединения нет посторонних электролитов, то ионная сила такого раствора будет мала и f(Kn+) = f(Am-) = 1, а активности самих частиц будут равны их концентрациям.
В химическом анализе важно знать количество вещества, перешедшего в раствор, т.е. растворимость этого вещества (обозн.S).
КmAn Û mKn+ + nAm-
S mS nS
При растворении S молей вещества КmAn в 1 литре раствора образуется mS моль/л катионов Kn+ и nS моль/л анионов Am-.
Lp(КmAn) = [Kn+]m[Am-]n
Lp(КmAn) = [mS]m[nS]n
Lp(КmAn) = mmSm×nnSn
Lp(КmAn) = mmnnSn+m
S = 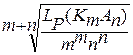 ; [S] = [моль/л]
; [S] = [моль/л]
Растворимость малорастворимых соединений зависит от следующих факторов:
1. От температуры.
2. От наличия постороннего электролита, не содержащего одноименных ионов.
3. От постороннего электролита, содержащего одноименные ионы;
4. От ионной силы раствора.






