КІ нест·КІІнест = Кнест
Величина оборотна константі нестійкості називається константою стійкості комплексу. Позначається β = 1/ Кнест
Значення констант наведені в довідниках. Часто наведені показники констант: рКнест = - lgКнест
Чим менше величина константи нестійкості, тим стійкіше комплексний іон.
Знання констант нестійкості дозволяє розрахувати рівноважні концентрації іонів в розчині, проводити порівняння міцності різних комплексів. Використання комплексних сполук має і медико-біологічне значення: так, якщо, організм перенасичений сполуками якого-небудь металу, отруюючи його, то вводять антидоти – нетоксичні ліганди, які утворюють стійкі комплекси з цим металом, які потім виводяться з організму. При дефіциті в організмі якого-небудь металу, його вводять у вигляді комплексної сполуки.
5.3. Вплив різних чинників на процес комплексоутворення
а) Вплив рН середовища
Такий вплив має місце особливо в тому випадку, коли в реакціях утворення комплексів або в побічних реакціях лігандів беруть участь катіони Гідрогену.
Так, [Ag(NH3)2]+ може існувати в нейтральних та слабко лужних середовищах, а в кислому він руйнується з утворенням осаду:
[Ag(NH3)2]++ 2H+ + Cl– F AgCl↓ + 2NH4+
Часто для повноти зв'язування катіону в комплекс
Ag++ 2NH3 F [Ag(NH3)2]+
реакцію комплексоутворення проводять в слабко лужному середовищі. При цьому гідроксильні-групи заважають взаємодії лігандів з іонами Гідрогену, зростає концентрація лігандів, а значить рівновага зміщується в бік утворення комплексу.
В сильно-лужному середовищі реакцію комплексоутворення не проводять, щоб запобігти гідролізу іонів металу та утворенню гідроксидів.
б) Вплив концентрації ліганду
Чим більше концентрація ліганду, тим повніше зв'яжеться метал в комплекс. Згідно з правилом Ле Шательє, при збільшенні концентрації вихідної речовини рівновага зміщується в бік перебігу прямого процесу, тобто утворення комплексної сполуки.
в) Вплив сторонніх іонів, що утворюють малорозчинні сполуки з металом-комплексоутворювачем
Як приклад розглянемо рівновагу
[Ag(NH3)2]+ F Ag+ + 2NH3
Цей комплекс достатньо стійкий: при кімнатній температурі Кнест= 6,1·10-8. Тобто рівновага зміщена в бік існування комплексу.
При введенні в розчин йодид-іонів можливе випадіння осаду
Ag+ + I– F AgI↓
Добуток розчинності цього осаду має дуже мале значення  = 8,3·10-17.
= 8,3·10-17.
Кнест([Ag(NH3)2]+) >  (AgI) = 8,3·10-17
(AgI) = 8,3·10-17
тому комплекс буде руйнуватись і буде випадати осад.
г) Вплив температури
Як і будь-які константи хімічної рівноваги, константи нестійкості залежать від температури. Рівновага комплексоутворення зміщується в той чи іншій бік в залежності від природи речовин.
5.4. Способи руйнування та утворення комплексів. Використання комплексних сполук в практиці аналізу
Для руйнування комплексного іону можна:
а) послабити здатність центрального іону до комплексоутворення (наприклад, змінити ступінь окиснення іону)
б) посилити дисоціацію комплексу (зменшуючи концентрації іонів або молекул, які оточують центральний іон).
Комплексні сполуки широко використовують в практиці аналізу. Наведемо кілька прикладів.
а) осадження катіонів та аніонів з розчинів. Наприклад:
2K+ + [PtCl6]2– = K2[PtCl6]↓
б ) розчинення осадів. Наприклад:
PbSO4 ↓ + 4OH– F [Pb(OH)4]2– + SO42–
в) розділення іонів шляхом дробного розчинення осадів. Наприклад:
Для відокремлення Ag+ - іонів від Hg2+ -іонів використовують здатність осаду AgCl ↓ розчинятись у розчині амоніаку (на відміну від Hg2Cl2):
AgCl¯ + 2NH3·H2O F [Ag(NH3)2]+ + Cl– + 2H2O
г) відкриття іонів за зміною забарвлення внаслідок утворення забарвлених сполук
4Fe3+ + 3[Fe(CN)6]4– F Fe4[Fe(CN)6]3↓ (синій осад)
д) маскування іонів в розчині.
Іони, які заважають відкриттю інших іонів в розчині, можна зв'язати в міцні комплекси. Наприклад: іони Co2+ і Fe3+ з NCS– утворюють комплексні сполуки
Co2+ + 4 NCS– F [Co(NCS)4]2– синій
Fe3+ + 3 NCS– F [Fe(NCS)3] червоний
Тому, в присутності Fe3+, не можна визначити Co2+ у вигляді комплексу [Co(NCS)4]2–.
Додаючи до розчину з катіонами фторид-іони, зв'язують Fe3+ в міцний комплекс:
Fe3+ + 6F– F [FeF6]3–
Кнест [FeF6]3– = 1,43·10-12 << Кнест[Fe (NCS)3] = 5,9·10-4.
ПРАКТИЧНА РОБОТА
ВИЗНАЧЕННЯ СТУПЕНЯ ОКИСНЕННЯ КОМПЛЕКСОУТВОРЮВАЧА. ОТРИМАННЯ КОМПЛЕКСНИХ СПОЛУК МЕТОДОМ
ВТІЛЕННЯ ТА ПРИЄДНАННЯ
Мета: Навчитися визначати ступінь окиснення комплексоутворювача та заряд комплексного іону.
Приклади
Приклад 1. Написати рівняння реакцій утворення калій гексаціаноферату (III). Записати рівняння первинної та вторинної дисоціації комплексної сполуки. Записати вираз сумарної константи нестійкості. Виписати довідникове значення.
Розв'язання
Запишемо хімічну формулу калій гексаціаноферату(III):
K3[Fe(CN)6]
Ця сполука містить катіони К+, Fe3+ та аніони CN- і відноситься до комплексних cполук, що утворені за типом приєднання.
3KCN + Fe(CN)3 = K3[Fe(CN)6]
Запишемо рівняння первинної дисоціації калій гексаціаноферату (III). За першим ступенем комплексна сполука дисоціює за типом сильного електроліту:
K3[Fe(CN)6] F 3K++ [Fe(CN)6]3-
Вторинна дисоціація комплексного іону проходить за типом слабкого електроліту – ступінчасто:
[Fe(CN)6]3- F [Fe(CN)5]2- + CN–
[Fe(CN)5]2- F [Fe(CN)4] - + CN–
[Fe(CN)4] - F [Fe(CN)3 ]0 + CN–
[Fe(CN)3]0 F [Fe(CN)2 ]+ + CN–
[Fe(CN)2 ]+ F [Fe(CN)] 2+ + CN–
[Fe(CN)]2+ F Fe3+ + CN–
Вираз для загальної константи нестійкості:

В довіднику наведене значення логарифму константи стійкості:
lg β (або lgКст.) = 43,9.
Тоді, β = 1043,9 = 7,9·1043
Визначаємо Кнест = 1/ β = 1/ 7,9·1043 = 1,3·10-44
Приклад 2. Визначте заряд комплексного іона [Co(NCS)4]x, в якому Со має ступінь окиснення 2+.
Розв'язання
Заряд іона Кобальту 2+, а заряд 4-х іонів одноосновної тіоціанатної кислоти дорівнює 4-.
+2 -1
[Co(NCS)4] x
 +2 + -4 = - 2
+2 + -4 = - 2
Алгебраїчна сума зарядів буде: +2+ (-4) = -2
Це і буде заряд комплексного іона: [Co(NCS)4]2-
Приклад 3. Визначити заряд комплексоутворювача в комплексному іоні [Аg(S2О3)]-.
Розв'язання
Позначимо заряд комплексоутворювача, іона Аргентума, через X, іон S2O  має заряд 2-.
має заряд 2-.
Х 2-
[Аg(S2О3) ]-
Тобто Х + (-2) = - 1; Х = +1
Це і буде заряд комплекоутворювача: Ag+.
Задачі для самостійної роботи
1. Написати рівняння реакцій утворення вказаної комплексної сполуки. Записати рівняння первинної та вторинної дисоціації комплексної сполуки. Записати вираз сумарної константи нестійкості:
1. калій гексаціаноферату(ІII);
2. гексаамінокупрума(ІІ) сульфату;
3. амоній тетратіоціанатокобальту(ІІ);
4. гексааміноплатина(ІV) хлориду;
5. тетраамінокупрумa(II) хлориду.
2. Визначити заряд комплексного іона:
1. [Fе2+(СN)6]х.
2. [Fе3+(СN6)]х.
3. [Рt4+(NН3)6]x.
4. [Pt4+(NH3)2Cl2]х
5. [Ag(NH3)2]x.
6. [AgCl2]х.
7. [AgS2O3]х.
8. [Cd2+(CN)4]х.
3. Визначити заряд комплексоутворювача в комплексній сполуці:
1. H2[PtCl6].
2. [Ni(NH3)6 ](OH)2.
3. H2[HgJ4].
4. K3[Co(NО2)6].
5. [Ni(NH3)4](OH)2.
6. [Ag(NH3)2]Cl.
7. K4[Fe(CN)6].
ЛАБОРАТОРНИЙ ПРАКТИКУМ
|
 З ЯКІСНОГО АНАЛІЗУ
З ЯКІСНОГО АНАЛІЗУ
Основні поняття
Аналіз речовини – отримання дослідним шляхом даних щодо хімічного складу речовин будь-якими можливими методами: хімічними, фізичними, фізико-хімічними.
Аналітична реакція – хімічне перетворення дослідної речовини під дією аналітичного реагенту з утворенням продуктів з вираженим аналітичним ефектом.
Аналітичні ознаки – такі властивості дослідної речовини або продуктів її перетворення, які дають підставу говорити про їх наявність – колір, запах, утворення або розчинення осаду, кристали певної форми, колір полум'я горілки тощо.
Граничне розбавлення – величина оборотна мінімальній концентрації.
Груповий реагент – речовина, яка дозволяє відкрити іони певної аналітичної групи.
Метод аналізу – це визначення принципів, які лежать в основі аналізу речовин.
Методика аналізу – детальний опис операцій, умов проведення аналізу, які забезпечують регламентовані характеристики результатів аналізу.
Мінімальна (гранична) концентрація – це найменша концентрація іонів або речовини, яку можна відкрити в невеликій порції дослідного розчину (об'єм – 0,01 -0,03 мл) за допомогою даної реакції.
Мінімум відкриття – найменша маса речовини (мкг), яка може бути визначена за допомогою даної реакції за певних умов у мінімальному об'ємі розчину.
Реагент – речовина, реакцією з якою можна відкрити досліджувану речовину або іон.
Селективна (виборча) аналітична реакція –реакція, яка дає аналітичний ефект у присутності обмеженого числа іонів.
Специфічна аналітична реакція – реакція, яка дозволяє визначати дану речовину в присутності інших речовин або іонів.
Чутливість реакції – найменша кількість речовини, яку можна відкрити за допомогою даної реакції.
Класифікація методів якісного аналізу
Методи якісного аналізу можна класифікувати за різними ознаками.
І. В залежності від складу досліджуваної системи

ІІ. В залежності від маси досліджуваної речовини
Згідно з рекомендаціями Міжнародної спілки з чистої та прикладної хімії (IUPAC) розрізняють макро-, мікро-, напівмікро- та субмікроаналіз (таблиця 3).
Таблиця 3.
Класифікація методів аналізу за величиною наважки
| Метод аналізу | Маса наважки, г | Об’єм, см3 | Спосіб виконання |
| Макроаналіз | 1-10 | 10-100 | виконують у звичайних пробірках, хімічних стаканах, колбах. Осад відокремлюють фільтруванням через паперові фільтри. |
| Напівмікроаналіз | 0,05-0,5 | 1-10 | виконують за допомогою крапельниць. Відділення твердої і рідкої фаз проводять за допомогою центрифуги. |
| Мікроаналіз | 10-3 – 10-6 | 10-1-10-4 | виконують краплинним або мікрокристалоскопічним методами. У мікрокристалоскопічному методі про наявності досліджуваних іонів судять по кольору і формі кристалів, їх спостерігають під мікроскопом. |
ІІІ. В залежності від використання реагенту певного типу (специфічного або групового) розрізняють:
|
|
IV. В залежності від способу виконання розрізняють реакції, що виконані:
|
|
Аналітичні ознаки реакцій
Таблиця 4.
| Аналітичні ознаки | Приклад |
| 1. Утворення характерного осаду | 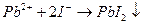 (жовтий осад)
(жовтий осад)
|
| 2. Зміна забарвлення розчину |  (червоний розчин)
(червоний розчин)
|
| 3. Виділення газу |  (характерний запах)
(характерний запах)
|
| 4. Виділення або поглинання тепла |  (з виділенням тепла)
(з виділенням тепла)
 (з поглинанням тепла)
(з поглинанням тепла)
|
ПРАВИЛА РОБОТИ І ТЕХНІКА БЕЗПЕКИ
В ХІМІЧНІЙ ЛАБОРАТОРІЇ
Загальні правила
1. Приступати до виконання практичної роботи лише після дозволу викладача.
2. Під час роботи в лабораторії необхідно підтримувати чистоту і порядок, а також додержуватись правил техніки безпеки.
3. Необхідно організувати роботу так, щоб раціонально використовувати робочий час.
4. Нагрівання пробірок з розчинами необхідно проводити на водяній бані, а не на відкритому вогні, щоб запобігти розбризкуванню і втраті рідини. При нагріванні розчинів слід направляти отвори пробірок від себе, не можна дивитися в них зверху.
5. Для визначення запаху речовин у пробірках чи склянках з рідинами необхідно легким рухом долоні руки направити потік повітря до себе і обережно понюхати.
6. Слід дотримуватись економного використання реактивів, води, електроенергії.
7. Категорично забороняється вживати їжу в лабораторії. Після роботи в лабораторії необхідно добре вимити руки.
Техніка безпеки при роботі з хімічними реактивами
1. Усі роботи з речовинами, при взаємодії яких утворюються шкідливі для організму гази або речовини з неприємним запахом, необхідно проводити під тягою. Категорично забороняється працювати з такими речовинами на робочому місці.
2. Під час роботи з концентрованими кислотами та лугами необхідно бути обережним та слідкувати за тим, щоб вони не попали на шкіру і одяг.
3. При розведенні концентрованої сульфатної кислоти необхідно обережно і поступово приливати кислоту до води, а не навпаки. Це пов'язано з тим, що при розведенні сульфатної кислоти виділяється велика кількість тепла. Тому при додаванні води до кислоти розчин може розбризкуватись і попасти на шкіру і одяг.
4. При роботі з великими об'ємами розчинів концентрованих кислот та лугів необхідно використовувати: гумові рукавички, фартух і захисні окуляри.
5. Розчини гідрогену сульфіду, кислот, лугів тощо необхідно зливати в спеціально відведений посуд, щоб запобігти руйнуванню каналізаційної системи в лабораторії. Розчини, які містять сполуки аргентуму, меркурію, плюмбуму, дийоду, необхідно зливати в окремий посуд для їх подальшої регенерації.
6. Якщо реакція перебігає в кислому або лужному середовищі, то розчин кислоти або лугу необхідно додавати краплями, кожного разу перемішуючи суміш скляною паличкою та контролюючи рН середовища, торкаючись цією паличкою індикаторного паперу.
7. Балони з ртуттю або заповнені нею прилади необхідно помістити на спеціальні підставки, щоб у разі пошкодження приладів основна маса ртуті потрапила на підставку, а не на робочий стіл чи підлогу. Якщо ртуть все ж таки розлилась, її треба дуже швидко зібрати за допомогою мідних дроту або пластинки, а потім засипати сіркою. Працювати з ртуттю дозволяється лише в спеціальних приміщеннях.
8. Нагрівання легкозаймистих речовин (діетилового етеру, спиртів, бензену тощо) проводять на водяній бані в колбі зі зворотним холодильником. Зберігати ці речовини необхідно в щільно закритих склянках невеликого вмісту.
9. Пробірки та склянки з горючими речовинами слід тримати на достатній відстані від пальників. Після закінчення роботи з ними необхідно загасити пальники, а лише потім мити посуд, що містить ці речовини.
10. Лужні метали слід обов'язково зберігати під шаром вільного від води і вологи гасу. Під час роботи з металічними натрієм або калієм необхідно уникати їх контакту з водою. Після закінчення роботи залишки цих металів потрібно перенести в спеціально відведені для них склянки.






