В розчинах солей, в яких перебігає гідроліз, встановлюється гідролітична рівновага. Константа гідролітичної рівноваги Кh називається константою гідролізу.
Ступенем гідролізуh називається величина, що дорівнює відношенню числа гідролізованих іонів сh до загальної концентрації с0 вихідних іонів:

Ступінь гідролізу залежить від концентрації розчину та температури: вона збільшується зі зменшенням концентрації та збільшенням температури.
За звичайних умов, гідролізується дуже незначна кількість іонів: h<<1.
2.3.1. Гідроліз солі, утвореної сильною основою та слабкою кислотою
Наприклад: гідроліз натрій ацетату
В розчині ця сіль дисоціює за рівнянням:
CH3COONa →CH3COO– + Na+
Гідроліз таких солей відбувається за «слабкою складовою» – аніоном:
CH3COO– + НОН ↔ CH3COOН + ОН–
Середовище в такому розчині обумовлює наявність гідроксильних груп, тобто лужне.
Вираз для константи гідролізу:

Якщо помножити чисельник та знаменник на [H+]

та після нескладних математичних перетворень, враховуючи, що
[H+]·[OH-] = Kw, отримаємо

де: Kа- константа іонізації кислоти
Ступінь гідролізу солі, що гідролізується за аніоном, обчислюють за формулою:

Значення рН в розчині таких солей визначається за формулою:

2.3.2. Гідроліз солі, утвореної сильною кислотою та слабкою основою
Наприклад: гідроліз амоній хлориду
В розчині ця сіль дисоціює за рівнянням:
NH4Cl → NH4+ + Cl–
Гідроліз солей цього типу відбувається за катіоном:
NH4+ + НОН ↔ NH3·Н2О + Н+
Середовище в розчині обумовлене наявністю протонів Н+ – кисле.
Вираз для константи гідролізу:

Помножимо чисельник та знаменник на [ОH-]

Враховуючи, що [H+]·[OH-]=Kw, отримаємо

де Kb- константа іонізації основи
Ступінь гідролізу обчислюють за формулою:

Значення рН в розчині солей, утворених слабкою основою та сильною кислотою визначається за формулою:
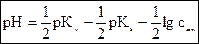
2.3.3. Гідроліз солі, утвореної слабкою кислотою та слабкою основою
Наприклад: гідроліз амоній ацетату
В розчині ця сіль дисоціює за рівнянням:
CH3COONH4 → CH3COO– + NH4+
Гідроліз таких солей відбувається і за аніоном, і за катіоном:
CH3COO– + NH4+ + НОН ↔ CH3COOН + NH3·Н2О
В результаті гідролізу утворилася слабка кислота та слабка основа, тому рН розчину можна визначити, порівнюючи константи іонізації кислоти та основи.
В даному випадку,
К(CH3COOН) = 1,74·10-5
К(NH3·Н2О) = 1,76·10-5
Тобто, фактично К(CH3COOН) ≈ К(NH3·Н2О), значить реакція середовища близька до нейтральної: рН ≈ 7.
Вираз для константи гідролізу:

Якщо помножити чисельник та знаменник на [H+] та [OH-] та після математичних перетворень, аналогічним попереднім випадкам, отримаємо

де: Kа, Кb – константи іонізації кислоти та основи
Ступень гідролізу солі, що гідролізується за катіоном та аніоном, обчислюють за формулою, яка має непростий вигляд:

Значення рН в розчині таких солей визначається за формулою:

Всі наведені формули для солей, що гідролізуються, зведені в таблицю додатку 3.
2.3.4. Зміщення рівноваги при гідролізі
Оскільки одним з продуктів гідролізу є катіони Гідрогену або гідроксильні групи, то на стан рівноваги процесу гідролізу суттєво впливає зміна рН розчину. Таким чином, змінюючи рН розчину можна або посилити, або подавити гідроліз. Цей прийом досить широко застосовується в практиці аналізу.
Наприклад, при приготуванні розчину солі ферум (ІІ) хлорид гідроліз є небажаним явищем, оскільки в результаті його перебігу (за звичайних умов по першому ступеню) концентрація ферум(ІІ)-іонів знижується за рахунок утворення основної солі:
Fe2+ + H2O F Fe(OH)+ + H+
FeCl2 + H2O F Fe(OH)Cl + HCl
Згідно з принципом зміщення рівноваги – принципом Ле Шательє, підвищивши концентрацію одного з продуктів реакції, можна досягти зміщення рівноваги в бік перебігу оборотної реакції. Тому, якщо додатково ввести в розчин H+, тобто підкислити його, гідроліз буде подавлятись, в розчині переважатимуть Fe2+.
Відповідно, якщо будемо мати сіль, яка гідролізується за аніоном, одним з продуктів гідролізу є гідроксильна група. Наприклад, гідроліз натрій карбонату за звичайних умов проходить за першим ступенем з утворенням гідрокарбонат-аніону та гідроксильних груп:
CO32– +H2O F HCO3– + OH–
Na2CO3 + H2O F NaHCO3 + NaOH
Тому для припинення гідролізу необхідно додати розчин лугу – підлужити розчин.
2.4. Буферні системи
 Буферні системи (або буферні розчини) – це розчини, які здатні зберігати приблизно незмінне значення рН при додаванні невеликої кількості сильних кислот або лугів
Буферні системи (або буферні розчини) – це розчини, які здатні зберігати приблизно незмінне значення рН при додаванні невеликої кількості сильних кислот або лугів
Буферні розчини можуть містити або індивідуальну речовину або суміш речовин (слабка основа та її сіль сильної кислоти; слабка кислота та її сіль сильної основи) (Табл.1.)
Принцип дії буферних розчинів полягає в тому, що окремі компоненти суміші зв'язують іони H+ або OH- при додаванні до цих розчинів кислот або основ, утворюючи при цьому слабкий електроліт.
Таблиця 1.
Приклади буферних розчинів та значення їх рН при 25°С
| Буферний розчин | кислотний | рН | лужний | рН |
| Індивідуальна речовина | KHC4H4O6 калій гідрогентартрат, насичений розчин | 3,57 | Na2B4O7·10H2O | 9,18 |
| Суміш речовин | Ацетатний CH3COOH + CH3COONa (ссолі = са=0,1 моль/дм3) | 4,75 | Амоніачний NH3·H2O + NH4Cl (ссолі = сb=1 моль/дм3) | 9,25 |
| Фосфатний KH2PO4+Na2HPO4 (с = 0,025 моль/дм3) | 6,86 | Карбонатний NaHCO3+Na2CO3 (С = 0,025 моль/дм3) | 10,012 |
Наприклад:
а) кислотний буферний розчин
Ацетатний буферний розчин: 0,1 М розчин CH3COOH + 0,1 М розчин CH3COONa забезпечує сталість значення рН за рахунок зміщення рівноваг:
CH3COOH + ОH- ↔ CH3COO- + H2О
CH3COO- + H+ ↔ CH3COOH
Виведення формули для розрахунку рН кислотного буферного розчину:
Ацетатна кислота, слабкий електроліт, дисоціює за рівнянням:
CH3COOH ↔ CH3COO- + H+.
Вираз для константи рівноваги процесу дисоціації

Звідси концентрація [H+]: 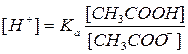
В розчині присутній також сильний електроліт натрій ацетат CH3COONa, який практично повністю дисоційований на іони:
CH3COONa → CH3COO- + Na+.
Концентрація кожного іона дорівнює концентрації солі:
[CH3COO- ] = [Na+] = ссолі.
Наявність значної кількості ацетат-іонів веде до зміщення рівноваги дисоціації кислоти в бік існування недисоційованих молекул оцтової кислоти, тому можна вважати, що рівноважна концентрація кислоти дорівнює її вихідній концентрації: [CH3COOН]=са. В такому випадку можна записати:

де: Ка-константа дисоціації кислоти;
са – концентрація кислоти;
ссолі – концентрація солі.
Логарифмуємо це рівняння та змінюємо знак на протилежний:
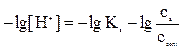
або

Це рівняння для визначення рН кислотного буферного розчину носить назву рівняння Гендерсона-Хассельбаха.
а) основний буферний розчин
Амоніачний буферний розчин: 1 моль/дм3 NH3 ·H2O + 1 моль/дм3 NH4Cl забезпечує сталість значення рН за рахунок зміщення рівноваг:
NH4+ + ОH- ↔ NH3·H2O
NH3 + H+ ↔ NH4+
Формула для розрахунку рОН основного буферного розчину виводиться аналогічно попередньому випадку:

де: Кb – константа дисоціації основи;
сb – концентрація основи;
ссолі – концентрація солі.
Оскільки рН = 14-рОН, тоді

Це рівняння для визначення рН основного буферного розчину.
Буферні розчини використовуються в практиці якісного та кількісного аналізу в тому випадку, коли необхідно підтримати стале значення рН середовища. Так, наприклад, при комплексонометричному визначенні катіонів деяких металів, використовують амоніачний буферний розчин.
Ацетатний буферний розчин використовують при якісному аналізі для відокремлення Ba2+ від іонів Ca2+ та Sr2+ за допомогою дихромат-іонів Cr2O72–.
Буферні системи мають велике медико-біологічне значення. Вони регулюють життєдіяльність організмів, де необхідне постійне значення рН: кров, лімфа. Наприклад, рН крові людини підтримується буферною системою на рівні 7,4.
Найважливішу роль в людському організмі мають: білкова, гемоглобінова, гідрокарбонатна, фосфатна буферні системи. В крові вирішальну роль відіграє гідрогенкарбонатний буферний розчин, а в тканинах – фосфатний.
ПРАКТИЧНА РОБОТА
РОЗРАХУНОК КОНСТАНТ ДИСОЦІАЦІЇ ТА СТУПЕНЯ ДИСОЦІАЦІЇ СЛАБКИХ ЕЛЕКТРОЛІТІВ. РОЗРАХУНОК рН БУФЕРНИХ РОЗЧИНІВ
Мета роботи: Навчитися розраховувати константи, ступені електролітичної дисоціації слабких електролітів та рН буферних розчинів.
Приклади
Приклад 1. Напишіть рівняння дисоціації ацетатної кислоти та математичний вираз константи дисоціації цієї кислоти. Знайдіть у довіднику, чому дорівнює константа дисоціації ацетатної кислоти.
Розв’язання
1. Ацетатна кислота – слабкий електроліт, у розчині дисоціює на іони:
СH3COOH ↔ СH3COO- + Н+
Процес електролітичної дисоціації – зворотний, тому для нього можна використати закон діючих мас:
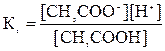
2. За довідником знайдемо значення константи дисоціації ацетатної кислоти:
Ка = 1,86·10-5
Приклад 2. Визначте константу дисоціації нітритної кислоти, якщо концентрація кислоти дорівнює 0,1 моль/дм3; ступінь дисоціації 6,6%.
 Дано:
Дано:
с(HNO2) = 0,1 моль/дм3 = 1·10-1моль/дм3
 α = 6,6%; α= 0,066 = 6,6·10-2
α = 6,6%; α= 0,066 = 6,6·10-2
Ка –?
Розв’язання
Згідно закону В.Оствальда для бінарних електролітів ступінь дисоціації дорівнює:
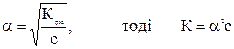
Визначимо константу дисоціації нітритної кислоти:
Ка = (6,6·10-2)2·10-1 = 4,36 ·10-4
Приклад 3. Визначте ступінь дисоціації амоніаку в розчині, якщо концентрація його 0,05 моль/дм3.
 Дано:
Дано:
 с(NН3·Н2О) = 0,05 моль/дм3 = 5·10-2 моль/дм3
с(NН3·Н2О) = 0,05 моль/дм3 = 5·10-2 моль/дм3
α –?
Розв’язання:
За довідником знайдемо значення константи дисоціації розчину амоніаку:

За законом В.Оствальда для бінарних електролітів:

Визначимо ступінь дисоціації розчину амоніаку:

Приклад 4. Розрахуйте рН форміатного буферного розчину, який містить у 1 дм3 розчину 0,3 моль кожного з компонентів
Розв'язання:
Форміатний буферний розчин має склад: НСООН + НСООNa, тобто відноситься до кислотних буферних систем.
Запишемо формулу для розрахунку рН:

З довідника виписуємо значення рКа(НСООН) = 3,75.
Підставляємо значення:

Завдання для самостійної роботи
1. Напишіть рівняння дисоціації та математичний вираз константи дисоціації наданої речовини. Знайдіть у довіднику, чому дорівнює константа її дисоціації за кожним ступенем:
1. форміатна кислота;
2. сульфідна кислота;
3. магній гідроксид;
4. алюміній гідроксид;
5. борна кислота.
2. Визначте константу дисоціації, якщо надані її концентрація (с,моль/дм3) та ступінь дисоціації (α,%):
| № | речовина | с, моль/дм3 | α,% |
| ацетатна кислота | 0,2 | 0,95 | |
| форміатна кислота | 0,001 | 3,68 | |
| ціанідна кислота | 0,1 | 0,007 | |
| гіпохлоритна кислота | 0,2 | 0,053 | |
| нітритна кислота | 0,1 | 6,6 |
3. Визначте ступінь дисоціації речовини, якщо її концентрація в розчині с моль/дм3:
| № | речовина | с, моль/дм3 |
| нітритна кислота | 0,001 | |
| гіпохлоритна кислота | 0,5 | |
| ацетатна кислота | 0,02 | |
| амоніак | 0,008 | |
| форміатна кислота | 0,025 |
4. Визначте рН буферного розчину, якщо в 1 дм3 містяться n моль компонентів суміші. Указати тип буферного розчину (кислотний чи основний)
| № | Буферний розчин | Компоненти суміші та їх вміст в 1 дм3 розчину, n моль | |
| карбонатний | 0,5 моль NaHCO3 | 0,03 моль Na2CO3 | |
| фосфатний | 0,1 моль NaH2PO4 | 0,005 мольNa2HPO4 | |
| бензоатний | 0,25 моль C6H5COOH | 0,25 моль C6H5COONa | |
| амоніачний | 0,15 моль NH3·H2O | 0,2 моль NH4Cl | |
| ацетатний | 0,2 моль CH3COOH | 0,25 моль CH3COONa |
ПРАКТИЧНА РОБОТА
РІВНОВАГА В РОЗЧИНАХ АМФОТЕРНИХ ЕЛЕКТРОЛІТІВ
Мета: Навчитися складати рівняння хімічних реакцій в розчинах амфотерних електролітів.
Катіони IV аналітичної групи з розчинами лугів утворюють гідроксиди, які мають амфотерні властивості, тобто розчиняються як у кислотах, так і у надлишку розчину лугу з утворенням гідроксоаніонів.
Наприклад:
ZnCl2 + 2NaOH → Zn(OH)2 ↓ + 2NaCl
Zn2+ + 2OH- → Zn(OH)2↓
Zn(OH)2↓ + 2NaOH → Na2[Zn(OH)4]
Zn(OH)2↓ + 2 ОH- → [Zn(OH)4]2- (тетрагідроксоцинкат-аніон)
Zn(OH)2↓ + 2HNO3 → Zn(NO3)2+2H2O
Zn(OH)2↓ +2H+ → Zn2++2H2O
Гідроксоаніони стійкі тільки у лужному середовищі. При зменшенні рН розчинів, наприклад, при додаванні хлоридної кислоти, вони спочатку утворюють осади відповідних гідроксидів:
Na2[Zn(OH)4] + 2HCl → Zn(OH)2↓ + 2H2O + 2NaCl
[Zn(OH)4]2- + 2H+ → Zn(OH)2↓ + 2H2O
При цьому встановлюється рівновага, напрямок якої можна змінювати регулюванням рН середовища.
При подальшому додаванні хлоридної кислоти осади розчиняються.
Zn(OH)2↓ + 2HCl →ZnCl2+2H2O
Zn(OH)2↓ + 2H+ → Zn2+ + 2H2O
Явище амфотерності відіграє велику роль у хімічному аналізі. Наприклад, для того щоб відокремити катіони IV аналітичної групи (Zn2+, Cr3+, A13+, Sn2+, Sn(IV)) від катіонів V і VІ аналітичних груп.
Завдання для самостійної роботи
1. Записати рівняння хімічних реакцій у молекулярному та молекулярно-іонному виглядах одержання гідроксидів наданних катіонів:
Zn2+; Cr3+; Al3+; Sn2+; Pb2+
2. Довести амфотерні властивості одержаних гідроксидів.
Глава 3. Рівновага в гетерогенних системах
3.1. Добуток розчинності
Гетерогенною називають систему, яка складається з кількох фаз (рідкої, твердої чи газоподібної), які мають поверхню поділу між фазами. Наприклад, з двох рідин, що не змішуються або твердої та рідкої фази.
Закон діючих мас застосовується і для гетерогенних систем.
Гетерогенна рівновага – це рівновага, яка встановлюється на межі поділу фаз.
Найчастіше в практиці аналітичної хімії зустрічаються гетерогенні системи типу: осад (тверда фаза) речовини, що знаходиться в рівновазі з його насиченим розчином (рідка фаза). Абсолютно нерозчинних речовин не існує, тому, якщо утворюється осад, то рідина над розчином – це насичений розчин малорозчинного електроліту.
Наприклад:
BaSO4(т) F Ba2+ + SO42–
Молярною розчинністю речовиниS називають число моль розчиненої речовини, яка міститься в 1 дм3 його насиченого розчину:
 , моль/ дм3
, моль/ дм3
Добуток розчинності малорозчинного –це величина, яка дорівнює добутку рівноважних концентрацій іонів даного електроліту в його насиченому розчині, взятих в ступенях, що дорівнюють відповідним стехіометричним коефіцієнтам. Позначається символами ДР,L, K 
Будемо дотримуватись позначення, рекомендованого ІЮПАК - K  .
.
Запишемо вираз константи гетерогенної рівноваги для BaSO4

Оскільки для малорозчинної речовини можна вважати концентрацію майже незмінною, вносимо [BaSO4] під знак константи, отримуючи нову сталу величину:

Правило добутку розчинності (В.Нернст, 1889):
 Добуток концентрацій малорозчинної сполуки в її насиченому розчині при постійній температурі є величина стала.
Добуток концентрацій малорозчинної сполуки в її насиченому розчині при постійній температурі є величина стала.
Згідно з рівнянням BaSO4(т) F Ba2+ + SO42–,
[Ba2+] = [SO42–]= S(BaSO4)
Тоді:

Знаючи довідникове значення K  , можна визначити розчинність
, можна визначити розчинність

В загальному випадку для гетерогенної рівноваги
KnAm ↔ nKm+ + mAn+
Добуток розчинності
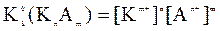
Тоді формула для визначення молярної розчинності:
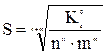 , моль/дм3
, моль/дм3
Добуток розчинності дозволяє визначити умови утворення насичених, ненасичених та пересичених розчинів.
Так, для розчину умовного електроліту KnAm, якщо:

З ненасиченого розчину осад випадати не буде.
Якщо іонний добуток буде більше за добуток розчинності (розчин пересичений), то осад випадатиме. І це буде відбуватись доти, поки концентрації іонів в розчині не будуть дорівнювати їх розчинності в насиченому розчині.
Таким чином, умова утворення осаду:
 > K
> K 
3.2. Порядок дробного (вибіркового) осадження
За значеннями добутку розчинності та молярної розчинності можна здійснювати вибіркове осадження різних іонів, що використовується в якісному аналізі.
Наприклад, при додаванні сульфат-іонів до розчину, що містить катіони Ca2+, Sr2+, Ba2+ можливі реакції:
Ca2+ + SO42– → CaSO4↓ K  = 2,5·10-5
= 2,5·10-5
Sr2+ + SO42– → SrSO4↓ K  = 3,2·10-7
= 3,2·10-7
Ba2+ + SO42– → BaSO4↓ K  = 1,1·10-10
= 1,1·10-10
Порівнюючи значення K  подібних бінарних електролітів,можна відмітити, що першим буде випадатиBaSO4, потім SrSO4, потім CaSO4. Порядок розчинення суміші цих осадів буде оборотним. Таким чином можна порівнювати подібні електроліти.
подібних бінарних електролітів,можна відмітити, що першим буде випадатиBaSO4, потім SrSO4, потім CaSO4. Порядок розчинення суміші цих осадів буде оборотним. Таким чином можна порівнювати подібні електроліти.
Якщо електроліти не подібні, то порівнювати треба не добуток розчинності, а значення молярної розчинності цих осадів.
Наприклад: визначити послідовність осадження хромат- та сульфат-іонів при додаванні розчину, що містить Pb2+
SO42– + Pb2+ F PbSO4↓ K  = 1,6·10-8
= 1,6·10-8
S = 
CrO42– + Pb2+ F PbCrO4↓ K  = 1,8·10-14
= 1,8·10-14
S = 
Виходячи з значень розчинності, в першу чергу осаджуються хромат-іони, а потім сульфат-іони.
3.3. Чинники, що впливають на осадження осадів та їх розчинність
а) Розчинність малорозчинної сполуки в присутності однойменних іонів
Якщо в систему, в якій має місце гетерогенна рівновага, додати однойменний іон, то у відповідності з принципом Ле Шательє рівновага зміститься в бік оборотної реакції.
Так, якщо в систему
BaSO4(т) F Ba2+ + SO42–
ввести розчин Na2SO4, то сумарна кількість аніонів збільшиться.
Згідно з правилом добутку розчинності при збільшенні концентрації одного з іонів (SO42–), що входять до складу осаду, концентрація інших іонів (Ba2+) буде зменшуватись, оскільки значення K0S = const. Катіони Ba2+ будіть зв'язуватись з надлишком SO42–. Це призведе до збільшення маси осаду та зменшенню його розчинності.






