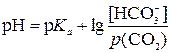 , откуда
, откуда  ,
,
где pH – водородный показатель крови; р Кa – суммарный показатель константы диссоциации;  – искомое соотношение между концентрацией гидрокарбонат-ионов и парциальным давлением диоксида углерода в крови.
– искомое соотношение между концентрацией гидрокарбонат-ионов и парциальным давлением диоксида углерода в крови.
Осмометрия
12. Смесь, содержащая m 1 г неэлектролитаВи m 2 г растворителя, плавится при t пл. р-ра 165 °С. Найти молекулярную массу неэлектролита В, если температура плавления растворителя t пл. р-ля °С, а ее криоскопическая постоянная равна K к К·кг/моль.
Решение.
D Т зам = t пл. р-ля – t пл. р-ра ,
где D Т зам – понижение температуры замерзания раствора относительно растворителя, К; t пл. р-ля – температура плавления растворителя, 0C; – t пл. р-ра – температура плавления раствора (смеси), 0C.
Согласно второму закону Рауля для растворов неэлектролитов
D Т зам = К к cm, откуда  ,
,
где К к – криоскопическая константа растворителя, К·кг/моль; cm – моляльная концентрация В, моль/кг.
По определению
 откуда
откуда 
где 1000 г/кг – пересчетный коэффициент; n – количество вещества В, моль; m 2 – физическая масса растворителя, г; m 1 – физическая масса В, г; M – молярная масса В, г/моль.
Mr = │M │,
где Mr – искомая молекулярная масса В, а.е.м.
12. При T К давление насыщенного пара над чистым растворителем равно p 0 кПа. Сколько граммов неэлектролитаВнадо растворить в m 1 г растворителя, чтобы понизить давление пара на Δ p Па?
Решение.
Согласно первому закону Рауля для растворов неэлектролитов
 ,
,
где χ– мольная доля В; Δ p –понижениедавления насыщенного пара над раствором относительно чистого растворителя; Па; 1000 Па/кПа – пересчетный коэффициент; p 0 – давление насыщенного пара над чистым растворителем, кПа.
По определению
 откуда
откуда 
где n 2 и n 1 – количества вещества В и растворителя, моль; m 1 – физическая масса растворителя, г; m 2 – искомаяфизическая масса неэлектролитаВ, г; M 1 и M 2 – молярные массы растворителя и В соответственно, г/моль.
13. При t °С давление насыщенного пара чистого растворителя составляет p 0 кПа. Найти при той же температуре давление насыщенного пара над ω %-ным раствором неэлектролитаВ.
Решение.
m 1 = ω, m 2= 100 – ω,
где m 1 и m 2 – физические массы В и растворителя в 100 г раствора, г; ω – массовая доля В, %.
 ,
,
где n 1 и n 2 – количества вещества В и растворителя в 100 г раствора, моль; M 1 и M 2 – молярные массы В и растворителя, г/моль.
По определению
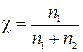 ,
,
где χ – мольная доля В.
Согласно первому закону Рауля для растворов неэлектролитов
 , откуда
, откуда 
где p 0 – давление насыщенного пара чистого растворителя, кПа; p – искомое давления насыщенного пара над раствором, кПа.
14. Раствор, содержащий m 1 г вещества В в m 2 г растворителя, кристаллизуется при температуре на D Т зам °С ниже, чем чистый растворитель. Определить, происходит ли диссоциация или ассоциация вещества В в этом растворе, и в какой степени. Криоскопическая константа растворителя равна К к К·кг/моль.
Решение.
Согласно второму закону Рауля для растворов неэлектролитов
D Т зам = К к cm, откуда 
где D Т зам – понижение температуры замерзания раствора относительно растворителя, °С; К к – криоскопическая константа растворителя, К·кг/моль; cm – моляльная концентрация В, моль/кг.
По определению
 откуда
откуда 
где 1000 г/кг – пересчетный коэффициент; n – количество вещества В, моль; m 2 – физическая масса растворителя, г; m 1 – физическая масса В, г; M – молярная масса В в растворе, г/моль.
Если M > M (В), то происходит ассоциация вещества В в этом растворе, и
 ,
,
где β – степень ассоциации; M ( В) – молярная масса индивидуального вещества В, г/моль.
Если M < M (В), то происходит диссоциация вещества В в этом растворе, и
 ,
,
где α – степень диссоциации.
15. Температура замерзания водного раствора неэлектролитаВравна Т зам р-ра К. Давление пара чистой воды при этой же температуре равно p 0 Па, а энтальпия плавления льда составляет Δ H пл Дж/моль. Найти давление пара раствора сахара.
Решение.
 ,
,
где К к – криоскопическая константа растворителя (воды), К·кг/моль; R = 8,31  – универсальная газовая постоянная; Т зам р-ля – температура замерзания растворителя (воды), К; M – молярная масса растворителя, г/моль; Δ H пл – энтальпия плавления растворителя (льда), Дж/моль.
– универсальная газовая постоянная; Т зам р-ля – температура замерзания растворителя (воды), К; M – молярная масса растворителя, г/моль; Δ H пл – энтальпия плавления растворителя (льда), Дж/моль.
D Т зам = T зам. р-ля – T зам. р-ра,
где D Т зам – понижение температуры замерзания раствора относительно растворителя, К; T зам. р-ра – температура замерзания раствора, K.
Согласно второму закону Рауля для растворов неэлектролитов
D Т зам = К к cm, откуда 
где cm – моляльная концентрация В, моль/кг.
 ,
,
где χ – мольная доля В.
Согласно первому закону Рауля для растворов неэлектролитов
 , откуда
, откуда  ,
,
где p 0 – давление насыщенного пара чистой воды, Па; p – искомое давления насыщенного пара раствора, Па.
16. Водный раствор неэлектролитаВкристаллизуется при t лзам. р-ра °С. Моляльная концентрация этого раствора равна __ моль/кг. Криоскопическая константа воды равна К к К·кг/моль.
Решение.
D Т зам = t зам. воды – t зам. р-ра,
где D Т зам – понижение температуры замерзания раствора относительно растворителя, К; t зам. р-ра – температура замерзания раствора, 0C; t зам. воды – температура замерзания воды, 0C.
Согласно второму закону Рауля для растворов неэлектролитов
D Т зам = К к cm, откуда  ,
,
где К к – криоскопическая константа растворителя, К·кг/моль; cm – искомая моляльная концентрация В, моль/кг.
17. Сколько моль неэлектролитаВ нужно растворить в m кг воды для получения раствора, температура кипения которого равна t кип. р-ра °С? Эбулиоскопическая константа воды равна К э К·кг/моль.
Решение.
D Т кип = t кип. р-ра – t кип. воды,
где D Т кип – повышение температуры кипения раствора относительно воды, К;
t кип. р-ра – температура кипения раствора, °С; t кип. воды – температура кипения воды, °С.
Согласно второму закону Рауля для растворов неэлектролитов
D Т кип = К э cm, откуда  ,
,
К э – эбулиоскопическая константа воды, К·кг/моль; cm – моляльная концентрация неэлектролитаВ, моль/кг.
По определению
 откуда
откуда 
где n – искомоеколичество вещества В, моль; m – физическая масса воды, кг.
18. Раствор, содержащий m 1 г неэлектролита В в m 2 кг воды, кипит при t кип. р-ра °С. Молярная масса этого вещества равна __ г/моль. Эбулиоскопическая константа воды равна К э К·кг/моль.
Решение.
D Т кип = t кип. р-ра – t кип. воды,
где D Т кип – повышение температуры кипения раствора относительно воды, К;
t кип. р-ра – температура кипения раствора, °С; t кип. воды – температура кипения воды, °С.
Согласно второму закону Рауля для растворов неэлектролитов
D Т кип = К э cm, откуда  ,
,
К э – эбулиоскопическая константа воды, К·кг/моль; cm – моляльная концентрация неэлектролитаВ, моль/кг.
По определению
 откуда
откуда 
где n – количество вещества В, моль; m 2 – физическая масса воды, кг.

где M – искомая молярная масса В, г/моль; m 1 – физическая масса В, г.
19. Температура кипения ω%-ного водного раствора электролита равна t кип. р-ра °С. Эбулиоскопическая константа воды равна К э К·кг/моль. Определите изотонический коэффициент раствора электролита.
Решение.
D Т кип = t кип. р-ра – t кип. воды,
где D Т кип – повышение температуры кипения раствора относительно воды, К;
t кип. р-ра – температура кипения раствора, °С; t кип. воды – температура кипения воды, °С.
m 1 = ω, m 2= 100 – ω,
где m 1 и m 2 – физические массы В и воды в 100 г раствора, г; ω – массовая доля В, %.
 ,
,
где n – количество вещества В в 100 г раствора, моль; M – молярная масса В, г/моль.
По определению

где cm – моляльная концентрация электролитаВ, моль/кг; 1000 г/кг – пересчетный коэффициент; m 2 – физическая масса воды, г.
Согласно второму закону Рауля для растворов электролитов
D Т кип = iК э cm. откуда  .
.
где D Т кип – повышение температуры кипения раствора относительно воды, К; i – искомыйизотонический коэффициент раствора; К э – эбулиоскопическая константа воды, К·кг/моль.






