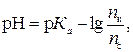 откуда
откуда 
где pH – водородный показатель буферного раствора; р Кa – показатель константы диссоциации кислоты; n к – количество вещества кислоты, ммоль.
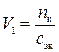 ,
,
где V 1 – искомый объем раствора кислоты, мл; с эк – молярная концентрация эквивалентов раствора кислоты, моль/л.
6. Найти величину буферной емкости буферного раствора, если после добавления V 2 мл c эк н. раствора щелочи к V 1 мл этого раствора pH последнего увеличивается с pH1 до pH2.
Решение.
 ,
,
где  – искомая буферная емкость по щелочи, моль/л; с эк – молярная концентрация эквивалентов раствора щелочи, моль/л; V 2 – объем раствора щелочи, мл; pH2 и pH1 – значения водородного показателя буферного раствора после и до добавления щелочи; V 1 – исходный объем буферного раствора, мл.
– искомая буферная емкость по щелочи, моль/л; с эк – молярная концентрация эквивалентов раствора щелочи, моль/л; V 2 – объем раствора щелочи, мл; pH2 и pH1 – значения водородного показателя буферного раствора после и до добавления щелочи; V 1 – исходный объем буферного раствора, мл.
7. Определить буферную емкость системы, если для изменения ее pH от pH1 до pH2 добавили к V 1 мл системы V 2 мл c эк н. сильной кислоты.
Решение.
 ,
,
где  – искомая буферная емкость по кислоте, моль/л; с эк – молярная концентрация эквивалентов раствора кислоты, моль/л; V 2 – объем раствора кислоты, мл; pH2 и pH1 – значения водородного показателя буферной системы после и до добавления кислоты; V 1 – исходный объем буферной системы, мл.
– искомая буферная емкость по кислоте, моль/л; с эк – молярная концентрация эквивалентов раствора кислоты, моль/л; V 2 – объем раствора кислоты, мл; pH2 и pH1 – значения водородного показателя буферной системы после и до добавления кислоты; V 1 – исходный объем буферной системы, мл.
8. Активная кислотность биологической жидкости равна [H+] моль/л. Найти pH жидкости.
Решение.
pH = –lg[H+],
где pH – искомое значение водородного показателя; [H+] – активная кислотность, моль/л.
9. Определить концентрации гидроксид-ионов в крови человека при t 1 °С и при t 2 °С, если при t 1 °С показатель ионного произведения воды равен р Кw, 1, а при t 2 °С – р Кw, 2. Водородный показатель крови при обеих температурах равен pH.
Решение.
 ,
,  ,
,
где  и
и 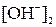 – искомые концентрации гидроксид-ионов, моль/л; pH – водородный показатель крови; р Кw, 1 и р Кw, 2 – показатели ионного произведения воды при температурах t 1 °С и t 2 °С соответственно.
– искомые концентрации гидроксид-ионов, моль/л; pH – водородный показатель крови; р Кw, 1 и р Кw, 2 – показатели ионного произведения воды при температурах t 1 °С и t 2 °С соответственно.
10. Определить pH раствора, содержащего n осн моль основания и n c моль соли, если показатель константы диссоциации основания равен р Кb.
Решение.
Согласно уравнению Гендерсона-Гассельбаха для оснóвной буферной системы
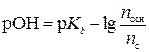 ,
,
где pOH – гидроксидный показатель раствора; р Кb – показатель константы диссоциации основания; n осн – количество вещества основания, моль; n c – количество вещества соли, моль.
При комнатной температуре
pH = 14 – pOH,
где pH – искомый водородный показатель раствора; 14 – показатель ионного произведения воды.
11. Каково соотношение между концентрацией гидрокарбонат-ионов и парциальным давлением диоксида углерода в крови, водородный показатель которой равен pH, если для такой буферной системы в крови человека суммарный показатель константы диссоциации равен р Кa?
Решение.






