Если система помещена в адиабатическую оболочку, то единственным способом изменения внутренней энергии является производство над ней макроскопической работы, что достигается путём изменения внешних параметров. Однако если адиабатической изоляции нет, то изменение внутренней энергии можно и без производства макроскопической работы. Так при соприкосновении горячего и холодного тела внутренняя энергия переходит от горячего тела к холодному, хотя при этом макроскопическая работа не совершается.
Процесс обмена внутренними энергиями соприкасающихся тел, не сопровождающийся производством макроскопической работы, называется теплообменом. Энергия, переданная телу окружающей средой в результате теплообмена, называется количеством теплоты или просто теплом полученным телом в таком процессе.
Изменение внутренней энергии тела во время теплообмена обусловлено работой каких-то внешних сил. Но это не макроскопическая работа, связанная с изменением внешних макроскопических параметров. Она является микроскопической работой, т. е. складывается из работ производимых молекулярными силами, с которыми на молекулы и атомы тела действуют молекулы и атомы окружающей среды.
 Сформулируем математически первое начало термодинамики с учётом теплообмена.
Сформулируем математически первое начало термодинамики с учётом теплообмена.
Пусть термодинамическая система I находиться в тепловом контакте с системой II (рис.1). Вся система I + II заключена в адиабатическую оболочку, однако граница AB между системами является теплопроводящей. В этих условиях система I+II не может общаться с окружающей средой, однако теплообмен между системами I и II может происходить. Допустим оболочка, в которую заключена система II жёсткая, так что система II никакой работы не производит. Система I может совершать работу над окружающей средой.
Пусть система I + II перешла из произвольного состояния 1 в состояние 2. В результате совершается работа A12 над внешними телами. Эту работу совершила только система I.
Так как составная система I + II адиабатически изолирована
 ,
,
где  - внутренняя энергия системы I в первом состоянии,
- внутренняя энергия системы I в первом состоянии, 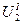 -внутренняя энергия системы I во втором состоянии. Аналогично,
-внутренняя энергия системы I во втором состоянии. Аналогично,  - внутренние энергии системы II в состояниях 1 и 2 соответственно. Поскольку нас интересует поведение только системы I, перепишем последнее соотношение таким образом.
- внутренние энергии системы II в состояниях 1 и 2 соответственно. Поскольку нас интересует поведение только системы I, перепишем последнее соотношение таким образом.
 . (1.11)
. (1.11)
В связи с тем, что система II не может совершать макроскопическую работу, изменение её внутренней энергии может только за счёт передачи тепла из I системы. Количество теплоты, передаваемое первой системой ко второй обозначим через Q. Тогда по определению

и выражение (1.11) можно переписать в виде
 . (1.12)
. (1.12)
Это уравнение даёт математическую формулировку I закона термодинамики. Согласно этому закону тепло Q полученное системой идёт на приращение её внутренней энергии  и на производство внешней работы.
и на производство внешней работы.
Для бесконечно малого элементарного квазистатического процесса уравнение (1.12) принимает вид:
 . (1.13)
. (1.13)
В случае кругового процесса, при котором система возвращается в исходное состояние,  и, следовательно, в круговом процессе всё тепло, полученное системой, идёт на производство внешней работы,
и, следовательно, в круговом процессе всё тепло, полученное системой, идёт на производство внешней работы, 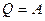 .
.
Если U1=U2 и Q=0, то A=0. Это означает, что невозможен процесс, единственным результатом которого является производство работы без каких либо изменений в других телах. Механизм, в котором осуществляется такой процесс, называется вечным двигателем I рода. Из первого начала термодинамики следует невозможность вечного двигателя I рода.






