Бензол и его ближайшие гомологи – бесцветные жидкости с характерным запахом (табл.1). Все они практически не смешиваются с водой, однако являются хорошими растворителями органических веществ.
Таблица 1. Физические свойства некоторых аренов
| Название | Т плавл., оС | Т кип., оС |
| Бензол | 5,5 | |
| Толуол | -95 | |
| Этилбензол | -94 | |
| о -Ксилол | -25 | |
| м -Ксилол | -47 | |
| п -Ксилол | ||
| Пропилбензол | -99 | |
| Изопропилбензол | -96 | |
| Стирол | -31 | |
| Фенилацетилен | -45 |
Многие ароматические углеводороды токсичны, причем вредны не только сами жидкости, но и их пары. Поэтому при работе с ними необходимо соблюдать особую осторожность. Разумеется, для нагревания аренов, как и других органических веществ, нельзя пользоваться открытым пламенем, так как они легко могут вспыхнуть. Их нагревают с помощью плиток или колбонагревателей с закрытой спиралью.
ХИМИЧЕСКИЕ СВОЙСТВА БЕНЗОЛА
РЕАКЦИИ ЗАМЕЩЕНИЯ
Для бензола наиболее характерны реакции замещения атомов водорода ароматического ядра, в которых сохраняется устойчивая шести-p-электронная ароматическая система.
Реакции замещения протекают по ионному механизму (точнее, по механизму электрофильного замещения, см. приложение 1). Важнейшими примерами реакций замещения в ароматическом ряду являются галогенирование, нитрование и алкилирование бензола.
ГАЛОГЕНИРОВАНИЕ
Замещение атома водорода в бензольном ядре на бром или хлор протекает в присутствии катализаторов – хлоридов алюминия и железа:
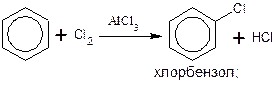
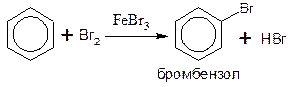
Обратите внимание на то, что в других условиях, например, при освещении или нагревании, взаимодействие бензола с хлором будет протекать не по ионному, а по радикальному механизму, что приведет к образованию других продуктов (см. разделы «Реакции замещения», «Особенности химических свойств гомологов бензола»).
НИТРОВАНИЕ
Реакция протекает под действием смеси концентрированных азотной HNO3 и серной H2SO4 кислот (нитрующая смесь):
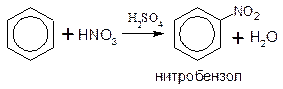
АЛКИЛИРОВАНИЕ
Алкилирование – это введение в молекулу алкильного радикала (-СН3, -С2Н5, -С3Н7 и др.), в результате чего образуются гомологи бензола.
Алкилирование бензола можно осуществить двумя путями. Во-первых, действием на бензол галогензамещенными алканами в присутствии катализаторов – галогенидов алюминия (алкилирование по Фриделю-Крафтсу):
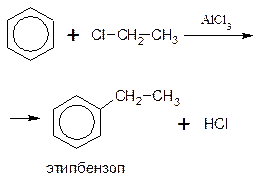
Во-вторых, взаимодействием бензола с этиленовыми углеводородами в присутствии кислотных катализаторов (алкилирование алкенами):
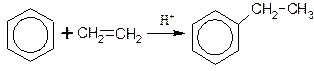
При алкилировании бензола пропиленом образуется преимущественно изопропилбензол[1]:
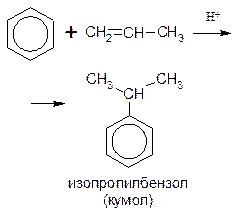
РЕАКЦИИ ПРИСОЕДИНЕНИЯ
В отдельных случаях бензол способен вступать в реакции присоединения.
Гидрирование бензола протекает при нагревании и высоком давлении в присутствии металлических катализаторов (Ni, Pt, Pd):
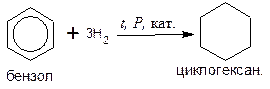
Аналогично протекает гидрирование и гомологов бензола, например:
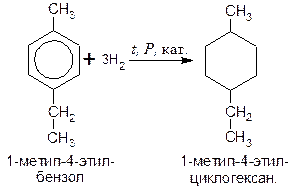
Присоединение хлора происходит при действии солнечного света или ультрафиолетового излучения на раствор хлора в бензоле. Одновременно присоединяются сразу три молекулы хлора и образуется твердый продукт – гексахлорциклогексан:
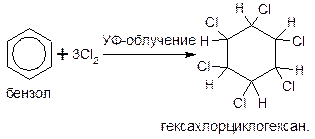
ОКИСЛЕНИЕ
Бензол устойчив к окислению: он, в отличие от непредельных углеводородов, не обесцвечивает раствор перманганата калия. При поджигании бензол горит ярким коптящим пламенем:
С6Н6 + 7,5О2 → 6СО2 + 3Н2О.
Лекция 6






