Алканы ряда метана, их общая формула и химическое строение гомологов данного ряда. Метан, химические свойства (горение, реакция замещения) и применение.
Алканы (предельные, насыщенные) – это нециклические углеводороды, в молекулах, которых атомы углерода связаны друг с другом только простыми (σ-связями). Алканы имеют общую формулу CnH2n+2, не присоединяют водород и другие элементы.
Природные источники алканов – нефть, природный газ.
Гомологический ряд алканов:
СН4 метан С6Н14 гексан
С2Н6 этан С7Н16 гептан
С3Н8 пропан С8Н18 октан
С4Н10 бутан С9Н20 нонан
С5Н12 пентан С10Н22 декан
Гомологами называются вещества сходные по свойствам, но различающиеся по строению молекул на одну или несколько групп - CH2-.
Изомерия алканов.
Изомеры – вещества, имеющие одинаковый состав молекул, но различное химическое строение. Например, существуют три изомера пентана С5Н12 :
CH3-CH2-CH2-CH2-CH3 н-пентан
CH3-CH-CH2-CH3 СН3
СН3 CH3-C-CH3
СН3
2-метилбутан 2,2-диметилпропан
Химические свойства.
1. Реакции замещения (галогенирование – идёт на свету)
СН4+Cl2 → CH3Cl+HCl
хлорметан
СН3Cl+Cl2 → CH2Cl2+HCl
дихлорметан
СН2Cl2+Cl2 → CHCl3+HCl
трихлорметан
СН3Cl+Cl2 → CCl4+HCl
тетрахлорметан
Горение
CH4 + 2O2 → CO2 +2H2O + Q
2C2H6 + 7O2 → 4CO2 + 6H2O + Q
Разложение.
СН4→ С+2Н2 (получение сажи и водорода)
2СН4→ С2Н2+3Н2 (получение ацетилена)
Изомеризация.
СН3-СН2-СН2-СН3 → СН3-СН-СН3
СН3
Применение алканов
Газообразные алканы используются в качестве ценного топлива. Алканы являются важным сырьём для получения разнообразных органических соединений – пластмасс, каучуков, синтетических волокон, моющих средств и многих других веществ.
Циклоалканы, их общая формула, строение, свойства, нахождение в природе, практическое значение.
Циклоалканы – циклические углеводороды с простыми связями и общей формулой СnН2n. Циклоалканы входят в состав нефти.
Гомологический ряд циклоалканов:


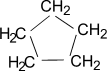

циклопропан циклобутан циклопентан циклогексан
Изомеры циклопентана С5Н10:

СН2-СН-СН3 СН – СН2-СН3
СН2-СН2 СН2-СН2
циклопентан 1-метилциклобутан 1-этилциклопропан
Химические свойства циклоалканов. Циклоалканы по свойствам сходны с алканами: малоактивны, горючи, атомы водорода в них могут замещаться галогенами.
1. Окисление. Циклоалканы горят, не обесцвечивают KMnO4
С4Н8 + 6О2→4СО2 + 4Н2О
2. Реакции замещения – галогенирование:

Практическое значение: циклоалканы входят в состав нефтепродуктов (топливо), используются как растворители органических веществ, из них получают ароматические углеводороды.
Алкены ряда этена (этилена), их общая формула и химическое строение гомологов данного ряда. Этилен, его химические свойства (горение, реакции присоединения и полимеризации) и применение.
Алкены – нециклические углеводороды с одной двойной связью и общей формулой СnН2n
Двойная связь – сочетание прочной σ–связи и непрочной π –связи.
Гомологический ряд алкенов:
СН2=СН2 этен
СН2=СН-СН3 пропен
СН2=СН-СН2-СН3 бутен-1
СН2=СН-СН2-СН2-СН3 пентен-1
Изомерия алкенов:
а) Изомерия положения двойной связи
СН2=СН-СН2-СН3 бутен-1 СН3-СН=СН-СН3 бутен-2
б) Изомерия углеродного скелета
СН2=С -СН3 2-метилпропен-1
СН3
Химические свойства этилена. Для алкенов характерны реакции окисления, присоединения, полимеризации.
Реакции окисления.
Алкены горят и обесцвечивают раствор KMnO4 (качественная реакция на двойную связь)
C2H4 + 3O2 → 2CO2+2H2O
Реакции присоединения.
а) Взаимодействие с водородом (гидрирование)
СН2=СН2+Н2→СН3-СН3
этен этан
б) Взаимодействие с галогенами (галогенирование)
СН2=СН2+Br2 → СН2Br-СН2Br (1,2-дибромэтан)
обесцвечивание бурой окраски раствора брома в воде служит качественной реакцией на наличие двойной связи.
в) Взаимодействие с галогеноводородами
СН2=СН2+НСl→СН3-СН2Cl (хлорэтан)
г) Взаимодействие с водой (гидратация)
СН2=СН2+Н2O→СН3-СН2OH (этанол)
Реакции полимеризации.
Полимеризация – соединение небольших молекул мономера в гигантские молекулы полимера:
n СН2=СН2 → (-СН2-СН2-) n
этилен полиэтилен
Получение этилена:
а) дегидрирование этана С2Н6 → С2Н4+Н2
б) дегидратация этанола С2Н5ОН → С2Н4+Н2О
Применение этилена: этиле н используется для получения полиэтилена, этилового спирта, уксусного альдегида и многих других органических соединений. Применяется как средство для ускоренного созревания фруктов.
Алкадиены, их строение, химические свойства (реакции присоединения и полимеризации), практическое значение.
Алкадиены – нециклические углеводороды, имеющие две двойные связи и общую формулу СnН2n-2
Гомологический ряд диенов:
СН2=С=СН2 пропадиен
СН2=СН-СН=СН2 бутадиен-1,3
СН2=СН-СН2-СН=СН2 пентадиен-1,4
Изомерия диенов:
а) изомерия положения двойных связей:
СН2=СН-СН2-СН=СН2 пентадиен-1,4
СН2=С=СН-СН2-СН3 пентадиен-1,2
б) изомерия углеродной цепи:
СН2=С-СН=СН2 2-метилбутадиен1,3
СН3
Химические свойства диенов. Для диенов характерны реакции окисления, присоединения, полимеризации.
1. Реакции окисления. Алкадиены горят, обесцвечивают раствор KMnO4.
Реакции присоединения
а) присоединение водорода (гидрирование)
СН2=СН-СН=СН2+Н2 → СН3-СН=СН-СН3
б) присоединение галогенов
СН2=СН-СН=СН2 + Cl2→ СН2Cl-СН=СН-СН2Cl
в) присоединение галогеноводородов
СН2=СН-СН=СН2+HCl → СН3-СН=СН-СН2Cl
Полимеризация
nСН2=СН-СН=СН2 → (-СН2-СН=СН-СН2-) n (каучук)
Получение бутадиена-1,3
а) из бутана: С4Н10→ С4Н6+2Н2
б) из спирта: 2С2Н5ОН→ С4Н6+2Н2+Н2О
Применение алкадиенов: получение каучуков.






