Молярной теплоёмкостью вещества называется физическая величина С, численно равная количеству тепла, которое нужно сообщить одному молю вещества для повышения его температуры на 1К в некотором термодинамическом процессе.
Молярная теплоёмкость
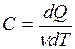 (ν – число молей газа).
(ν – число молей газа).
Для данного вещества величина С зависит от условий, при которых происходит передача тепла. Так, для газов молярная теплоёмкость Cp при изобарном процессе (p = const) отличается от молярной теплоёмкости Cv при изохорном процессе (V=const). Действительно, по первому началу термодинамики (dQ = dU + dA) для элементарного изохорного процесса dQ = dU, где U – внутренняя энергия одного моля газа и тогда 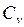 =
= 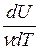 (dU = νCvdT). В то же время для элементарного изобарного процесса
(dU = νCvdT). В то же время для элементарного изобарного процесса
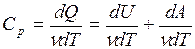
(dA =pdV - элементарная работа, совершенная газом при расширении).
В результате CP= CV+ 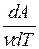 , т.е. Cp>Cv. Физический смысл этого можно пояснить следующим примером. Пусть газ заключен в цилиндр с подвижным поршнем. Если поршень закреплен, то для повышения температуры газа на dT ему нужно сообщить количество тепла dQ = νСvdT. Если же поршень свободен, то газ при нагревании расширяется, передвигая поршень, и совершает тем самым работу против внешних сил. Для этого требуется дополнительное количество тепла, так что dQp> dQv и Cp>Cv.
, т.е. Cp>Cv. Физический смысл этого можно пояснить следующим примером. Пусть газ заключен в цилиндр с подвижным поршнем. Если поршень закреплен, то для повышения температуры газа на dT ему нужно сообщить количество тепла dQ = νСvdT. Если же поршень свободен, то газ при нагревании расширяется, передвигая поршень, и совершает тем самым работу против внешних сил. Для этого требуется дополнительное количество тепла, так что dQp> dQv и Cp>Cv.
Так как dU =ν 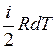 , а с другой стороны, dU=νCvdT, то
, а с другой стороны, dU=νCvdT, то 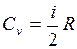 (i – число степеней свободы молекулы данного газа). Согласно уравнению Майера Cp = Cv + R. Тогда
(i – число степеней свободы молекулы данного газа). Согласно уравнению Майера Cp = Cv + R. Тогда 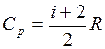 .
.
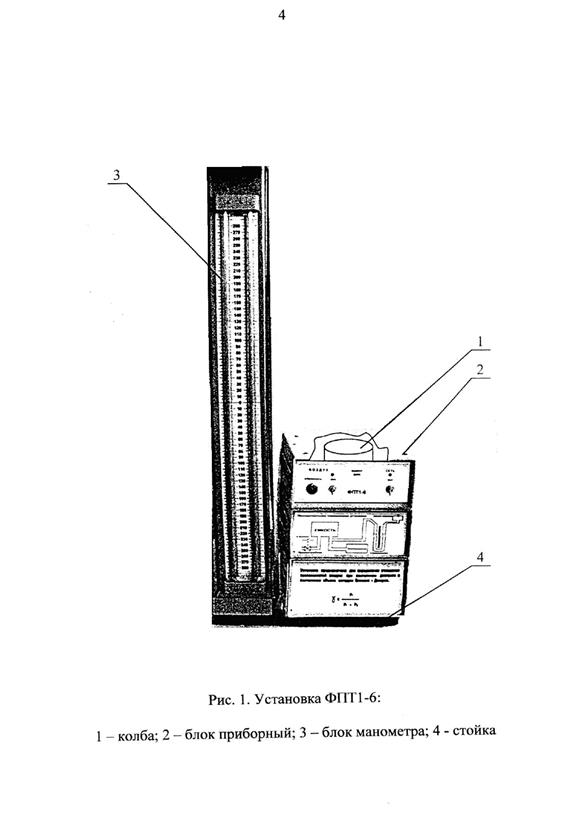

|
2→3 воздуха, оставшегося в колбе). Когда температура воздуха Т3 в сосуде сравняется с первоначальной Т1 (температурой окружающего воздуха), то давление воздуха в колбе станет равным p3. При адиабатическом расширении воздуха 1→2, согласно уравнению Пуассона:
p1V1γ = p2V2γ, (1)
где V1 – первоначальный объем воздуха, который при расширении займет объем Vк колбы. С другой стороны,
p1V1 = p3V3. (2)
так как в соотношении 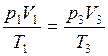 температура T1 равна температуре T3..
температура T1 равна температуре T3..
Поскольку V2=V3=Vк, то из (1) и (2) получаем:
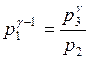 .
.
Отсюда (γ – 1)lg p1 = γlg p3 - lg p2 и тогда: 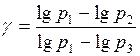 .
.
Так как в условиях опыта давления p1 и p3 мало отличаются от p2 (pа), то с достаточной точностью можно записать
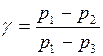 .
.
Так как второе колено манометра открыто, то p1 = pм1 + p2, p3 = pм2 + p2 , где pм1 и pм2 – показания манометра (в кПа) для установившихся состояний 1 и 3 соответственно. Тогда
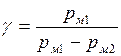 . (3)
. (3)




