Чиста вода дуже погано проводить електричний струм, але частково вона дисоціює – слабкий електроліт:
H2O ↔ H+ + ОН–
[H+] ∙ [OH–]
 Константа дисоціації: Кдис = = 1,8 ∙10 –16 (t°=22°С)
Константа дисоціації: Кдис = = 1,8 ∙10 –16 (t°=22°С)
[H2O]
Кдис була виміряна методом електропровідності.
Рівноважну концентрацію води можна вважати сталою величиною [H2O] = const, яка дорівнює її молярній концентрації:
[H2O] = 1000:18=55,56 моль/л
Тоді рівняння має вигляд:

1,8 ∙10 –16 ∙55,56 = [H+] ∙ [OH–] = 1∙10–14
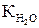 – стала при даній температурі величина, яку називають іонним добутком води. Із зміною температури
– стала при даній температурі величина, яку називають іонним добутком води. Із зміною температури 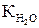 також змінюється:
також змінюється:
|
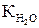 = 1∙10–14
= 1∙10–14
t°=30°С 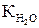 = 1,89∙10–14
= 1,89∙10–14
t°=50°С 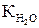 = 5,6∙10–14
= 5,6∙10–14
t°=100°С 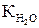 = 74∙10–14
= 74∙10–14
Як би не змінювалася концентрація [H+] чи [OH–], їх добуток залишається сталою величиною при певній температурі у будь-якому одному розчині.
Висновки:
· [H+] ∙ [OH–] = 10–14, тобто [H+] ∙ [OH–] ≠ 0, тому [H+] ≠ 0 та [OH–] ≠ 0
Тобто в розчині завжди присутні як H+, так і OH– незалежно від середовища.
· [H+] ∙ [OH–] = const, тому зміна [H+] приводить до зміни [OH–]
(наприклад, ↓[H+] супроводжується ↑[OH–])
У чистій воді: [H+] = [OH–] = √ 10–14 = 10–7 – нейтральне середовище.
У кислому середовищі: [H+] › [OH–]; [H+] ›10–7; [OH–]‹ 10–7 – кисле середовище.
У лужному середовищі: [H+] ‹ [OH–]; [H+] ‹10–7; [OH–]›10–7 – лужне середовище.
рН = – ℓg [H+] – водневий показник
рOН = – ℓg [OH–] – гідроксильний показник
 |
[H+] ∙ [OH–] = 10–14 прологарифмуємо: ℓg [H+] + ℓg [OH–] = –14
–ℓg [H+] – ℓg [OH–] = 14







