При какой температуре наступит равновесие в системе
BaO(кр.) + 0,5 O2(Г) D BaO2(кр.),
если DH0х.р. = -81,51 кДж, а DS0х.р. = -0,11 кДж×К?
Решение.
В состоянии равновесия энергия Гиббса равна нулю, DG = DH - TDS, если DG = 0, то DH = TDS. Из этого равенства можно рассчитать температуру, при которой наступит равновесие в системе:
Тр = 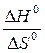 ; Tр =
; Tр = 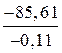 = 731,9 К или 458,9 °С.
= 731,9 К или 458,9 °С.
Задания
101. Энтальпии образования DН0298 оксида(II) и оксида(IV) азота соответственно равны +90,37 кДж и +33,85 кДж. Определите DS0298 и DG0298 для реакций получения NO и NO2 из простых веществ. Можно ли получить эти оксиды при стандартных условиях? Какой из оксидов образуется при высокой температуре? Почему? Ответ: +11,94 Дж/(моль× К); –60,315 Дж/(моль К); +86,81 кДж;
+51,82 кДж.
102. При какой температуре наступит равновесие системы
4HCI (г)+О2 (г) D 2Н2О (г) + 2С12 (г); DH = –114,42 кДж?
При каких температурах хлор или кислород в этой системе является более сильным окислителем? Ответ: 891 К.
103. Восстановление Fe3О4 оксидом углерода идет по уравнению
Fe3O4 (к) + СО (г) D 3FеO (к) + СО2 (г).
Вычислите DG0298 и сделайте вывод о возможности самопроизвольного протекания этой реакции при стандартных условиях. Чему равно DS0298 в этом процессе? Ответ: +24,19 кДж; +31,34 Дж×К.
104. Реакция горения ацетилена идет по уравнению
С2Н2 (г) + 5/2О2 (г) = 2СО2 (г) + Н2О (ж)
Вычислите DG0298 и DS0298. Объясните уменьшение энтропии в результате этой реакции. Ответ: –1235,15 кДж; –216,15 Дж×К.
105. Уменьшается или увеличивается энтропия при переходах: а) воды в пар; б) графита в алмаз? Почему? Вычислите DS0298 для каждого превращения. Сделайте вывод о количественном изменении энтропии при фазовых и аллотропических превращениях.
Ответ: а) 118,78 Дж/(моль К); б) –3,25 Дж/(моль К).
106. Чем можно объяснить, что при стандартных условиях невозможна экзотермическая реакция
Н2 (г) + СО2 (г) = СО (г) + Н2О (ж); DH = –2,85 кДж
Зная тепловой эффект реакции и абсолютные стандартные энтропии соответствующих веществ, определите DG0298 этой реакции.
Ответ: +19,91 кДж.
107. Прямая или обратная реакция будет протекать при стандартных условиях в системе
2NO (г) + O2 (г) D 2NO2 (г)
Ответ мотивируйте, вычислив DG0298 прямой реакции.
Ответ:–69,70 кДж.
108. Исходя из значений стандартных энтальпий образования и абсолютных стандартных энтропий соответствующих веществ, вычислите DG0298 реакции, протекающей по уравнению NH3 (г) + HCl (г) = NH4CI (к)
Может ли эта реакция при стандартных условиях идти самопроизвольно? Ответ: –92,08 кДж.
109. При какой температуре наступит равновесие системы
CO (г) + 2Н2 (r) D СH3OH (ж); rН = –128,05 кДж
Ответ:»385,5 К.
110. Эндотермическая реакция взаимодействия метана с диоксидом углерода протекает по уравнению
СH4 (г) + СO2 (г) = 2СО (г) + 2Н2 (г); DH = + 247,37 кДж
При какой температуре начнется эта реакция? Ответ:»961,9 К.
111. Определите DG0298 реакции, протекающей по уравнению
4NH3 (г) +5O2 (r) = 4NO (г) + 6Н2О (г)
Вычисления сделайте на основании стандартных энтальпий образования и абсолютных стандартных энтропий соответствующих веществ. Возможна ли эта реакция при стандартных условиях? Ответ: –957,77 кДж.
112. На основании стандартных энтальпий образования и абсолютных стандартных энтропий соответствующих веществ вычислите DG0298 реакции, протекающей по уравнению
СО2 (г) + 4Н 2 (г) = СН4 (г) + 2H2O (ж)
Возможна ли эта реакция при стандартных условиях?
Отве т: –130,89 кДж.
113. Вычислите изменение энтропии в реакции образования аммиака из азота и водорода. При расчете можно исходить из S0298 соответствующих газов, так как DS с изменением температуры изменяется незначительно. Чем можно объяснить отрицательные значения DS?
Ответ: –198,26 кДж/(моль К).
114. Какие из карбонатов: ВеСО3, CaCO3 или ВаСО3 можно получить по реакции взаимодействия соответствующих оксидов с CO2? Какая реакция идет наиболее энергично? Вывод сделайте, вычислив DG0298 реакций.
Ответ: +31,24 кДж; –130,17 кДж; –216,02 кДж.
115. На основании стандартных энтальпий образования и абсолютных стандартных энтропий соответствующих веществ вычислите DG0298 реакции, протекающей по уравнению
СО (г) + ЗН2 (г) = СН4 (г) + Н2О (г)
Возможна ли эта реакция при стандартных условиях?
Ответ: –142,16 кДж.
116. Образование сероводорода из простых веществ протекает по уравнению
Н2 (г) + S (ромб.) = H2S (г); DH = –20.15 кДж
Исходя из значений S0298 соответствующих веществ, определите DS0298 и DG0298 для этой реакции.
Ответ: +43,15 Дж×К); –33,01 кДж.117. На основании стандартных энтальпий образования и абсолютных стандартных энтропий соответствующих веществ вычислите DG0298 реакции, протекающей по уравнению
С2Н4 (г) + 3О2 (г) = 2СО2 (г) + 2Н2О (ж)
Возможна ли эта реакция при стандартных условиях?
Ответ: –1331,21 кДж.
118. Определите, при какой температуре начнется реакция восстановления Fe3O4, протекающая по уравнению
Fe3О4 (к) + СО (г) = 3FeO (к) + СО2 (г); DH = +34,55 кДж
Ответ: 1102,4 К.
119. Вычислите, при какой температуре начнется диссоциация пентахлорида фосфора, протекающая по уравнению
PCI5 (г) = PCI3 (г) + Cl2 (г): DH = +92,59 кДж
Ответ: 509 К.
120. Вычислите изменение энтропии для реакций, протекающих по уравнениям:
2СН4 (г) = C2H2 + ЗН2 (г)
N2 (г) + ЗН2 (г) = 2NH3 (г)
С(графит) + О2 (г) = СО2 (г)
Почему в этих реакциях DS0298 >0; <0; @0? Ответ: 220,21 Дж×К;
–198,26 Дж×К; 2,93 Дж×К.
Химическая кинетика и равновесие






