В основе многих заболеваний лежат нарушения функционирования ферментов в клетке - энзимопатии. Различают первичные (наследственные) и вторичные (приобретённые) энзимопатии. При первичных энзимопатиях дефектные ферменты наследуются, в основном, по аутосомнорецессивному типу. Гетерозиготы, чаще всего, не имеют фенотипических отклонений. Первичные энзимопатии обычно относят к метаболическим болезням, так как происходит нарушение определённых метаболических путей.
Фенилкетонурия (ФКУ). Фенилаланин (ФА) принадлежит к числу незаменимых аминокислот. Только часть ФА используется для синтеза белков; основное количество этой аминокислоты окисляется до тирозина. Реакцию гидроксилирования ФА катализирует фермент – фенилаланингидроксилаза. Причина ФКУ – недостаточность этого фермента. В результате этого нарушения ФА не превращается в тирозин, из которого образуется фенилпировиноградной кислоты (ФПВК), которая выделяется с мочой и потом, вследствие чего от больных детей исходит "мышиный" запах. Высокая концентрация ФПВК приводит к нарушению формирования миелиновой оболочки вокруг аксонов в ЦНС. ФПВК является нейротропным ядом, в результате чего повышаются возбудимость, тонус мышц, развиваются гиперрефлексия, тремор, судорожные эпилептиформные припадки. Позже присоединяются нарушения высшей нервной деятельности, умственная отсталость, микроцефалия. У больных детей наблюдается слабая пигментация из-за нарушения синтеза меланина. Диагностика заболевания осуществляется биохимическими методами: ещё до развития клинической картины в моче определяется ФПВК, в крови - высокое содержание фенилаланина. В родильных домах обязательно проводится скрининг-тест на фенилкетонурию.
Алкаптонурия. Нарушено окисление гомогентизиновой кислоты в тканях (гомогентизиновая кислота - промежуточный метаболит катаболизма тирозина). У таких больных наблюдают недостаточность фермента окисления гомогентизиновой кислоты - диоксигеназы гомогентизиновой кислоты, приводящей к развитию заболевания. В результате увеличиваются концентрация гомогентизиновой кислоты и выведение её с мочой. В присутствии кислорода гомогентизиновая кислота превращается в соединение чёрного цвета - алкаптон. Поэтому моча таких больных на воздухе окрашивается в чёрный цвет. Алкаптон также образуется и в биологических жидкостях, оседая в тканях, коже, сухожилиях, суставах. При значительных отложениях алкаптона в суставах нарушается их подвижность.
Альбинизм. При альбинизме нарушен синтез в меланоцитах пигментов - меланинов. Меланин находится в коже, волосах, радужке, пигментном эпителии сетчатки глаза и влияет на их окраску. При альбинизме наблюдают слабую пигментацию кожи, светлые волосы, красноватый цвет радужки глаза из-за просвечивающих капилляров. Проявление альбинизма связано с недостаточностью фермента тирозингидроксилазы (тирозиназы) - одного из ферментов, катализирующего метаболический путь образования меланинов.
Болезнь Хартнупа. Причина - недостаточность белков-переносчиков триптофана в кишечной стенке и почечных канальцах. Наблюдаются:повышенное образование индикана, который превращается в индиго синего цвета – симптом «голубых пеленок»; аминоацидурия; признаки пеллагры. нарушение психики. Лечение: полноценная белковая диета, прием никотинамида, предохранение от УФО.
ТВОРЧЕСКАЯ РАБОТА СТУДЕНТОВ. Тема реферативного сообщения/презентации -«Энзимопатии обмена аминокислот. Генетический скрининг новорожденных».
Лекция № 3. Конечные продукты обмена простых белков.
План лекции:
1. Реакции образования аммиака в организме. Токсичность аммиака.
2. Способы обезвреживание аммиака в организме. Орнитиновый цикл. Диагностическое значение определения мочевины.
3. Обмен креатина. Синтез креатина, образование креатинфосфата и креатинина. Диагностическое значение определения креатина, креатинина и креатинкиназы.
Содержание лекционного материала:
1. Реакции образования аммиака в организме. Токсичность аммиака.
Источники аммиака в организме:
a) Дезаминирование аминокислот.
b) Дезаминирование биогенных аминов.
c) Дезаминирование пуриновых и пиримидиновых азотистых оснований.
d) Гниение аминокислот в кишечнике.
Катаболизм аминокислот в тканях происходит постоянно со скоростью ∼100 г/сут. При этом в результате дезаминирования аминокислот освобождается большое количество аммиака. Значительно меньшие количества его образуются при дезаминировании биогенных аминов и нуклеотидов.
Часть аммиака образуется в кишечнике в результате действия бактерий на пищевые белки (гниение белков в кишечнике) и поступает в кровь воротной вены. Концентрация аммиака в крови воротной вены существенно больше, чем в общем кровотоке. В печени задерживается большое количество аммиака, что поддерживает низкое содержание его в крови. Концентрация аммиака в крови в норме редко превышает 25-40 мкмоль/л.
Аммиак - токсичное соединение. Даже небольшое повышение его концентрации оказывает неблагоприятное действие на организм, и прежде всего на ЦНС. Так, повышение концентрации аммиака в мозге до 0,6 ммоль вызывает судороги. К симптомам гипераммониемии относят тремор, нечленораздельную речь, тошноту, рвоту, головокружение, судорожные припадки, потерю сознания. В тяжёлых случаях развивается кома с летальным исходом.
2. Способы обезвреживание аммиака в организме.
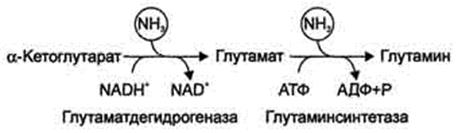
2.1. Локальный – в тканях. Основной реакцией связывания аммиака, протекающей во всех тканях организма, является синтез глутамина под действием глутаминсинтетазы:

Глутамин легко транспортируется через клеточные мембраны путём облегчённой диффузии (для глутамата возможен только активный транспорт) и поступает из тканей в кровь. Основными тканями-поставщиками глутамина служат мышцы, мозг и печень. С током крови глутамин транспортируется в почки и печень.
В мозге и некоторых других органах может протекать восстановительное аминирование α -кетоглутарата под действием глутаматдегидрогеназы, катализирующей обратимую реакцию. Однако этот путь обезвреживания аммиака в тканях используется слабо, так как глутаматдегидрогеназа катализирует преимущественно реакцию дезаминирования глутамата.
2.2. 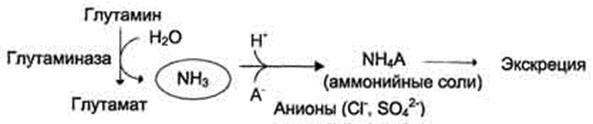 Образование аммонийных солей. В почках происходит гидролиз глутамина под действием глутаминазы с образованием аммиака. Образующийся аммиак нейтрализует кислые продукты обмена и в виде аммонийных солей, которые экскретируются с мочой:
Образование аммонийных солей. В почках происходит гидролиз глутамина под действием глутаминазы с образованием аммиака. Образующийся аммиак нейтрализует кислые продукты обмена и в виде аммонийных солей, которые экскретируются с мочой:
2.3. Орнитиновый цикл. Диагностическое значение определения мочевины.
Мочевина - основной конечный продукт азотистого обмена, в составе которого из организма выделяется до 90% всего выводимого азота. В норме концентрация мочевины в сыворотке/плазме крови – 2,61-8,35 ммоль/л (уреазный метод).
Мочевина выводится из организма с мочой. Азот мочевины составляет 85-90% от общего азота мочи. В норме у взрослых выводится мочевины с мочой 20-35 г/сут (330-580 ммоль/сут).
При повышении количества потребляемых с пищей белков экскреция мочевины увеличивается. Мочевина синтезируется только в печени. В 40-х годах XX века немецкие биохимики Г. Кребс и К. Гензелейт установили, что синтез мочевины представляет собой циклический процесс, состоящий из нескольких стадий, ключевым соединением которого, замыкающим цикл, является орнитин. Поэтому процесс синтеза мочевины получил название "орнитиновый цикл", или "цикл Кребса-Гензелейта".
Суммарное уравнение синтеза мочевины:
NH3 + Аспартат + СО2 + 3 АТФ + 2 Н2О → Мочевина + Фумарат + 2 АДФ +
+ 2Н3РО4 + АМФ + 2 ФФн
В первой реакции процесса аммиак связывается с СО2 с образованием карбамоилфосфата, при этом затрачиваются 2 молекулы АТФ. Реакция происходит в митохондриях гепатоцитов под действием фермента карбамоилфосфатсинтетазы I. Карбамоилфосфат затем включается в орнитиновый цикл и используется для синтеза мочевины.

Биологическая роль орнитинового цикла
Орнитиновый цикл в печени выполняет 2 функции:
· превращение азота аминокислот в мочевину, которая экскретируется и предотвращает накопление токсичных продуктов, главным образом аммиака;
· синтез аргинина и пополнение его фонда в организме.
Нарушение реакций обезвреживания аммиака может вызвать повышение содержания аммиака в крови - гипераммониемию, что оказывает токсическое действие на организм. Причинами гипераммониемии могут выступать как генетический дефект ферментов орнитинового цикла в печени, так и вторичное поражение печени в результате цирроза, гепатита и других заболеваний.
Все нарушения орнитинового цикла приводят к значительному повышению в крови концентрации аммиака, глутамина и аланина.
Гипераммониемия сопровождается появлением следующих симптомов:
- тошнота, повторяющаяся рвота;
- головокружение, судороги;
- потеря сознания, отёк мозга (в тяжёлых случаях);
- отставание умственного развития (при хронической врождённой форме).
Клинико-диагностическое значение исследования концентрации мочевины в сыворотке крови и моче.
Определение концентрации мочевины в сыворотке крови используется для оценки функции печени и выделительной функции почек. Критическая концентрация мочевины в крови: ˃28,0 ммоль/л. Причины увеличения концентрации мочевины в сыворотке крови: острые или хронические заболевания почек; обтурация мочевыводящих путей; снижение тока крови через почечные клубочки (застойная сердечная недостаточность, обширные ожоги, тяжелая диарея и рвота, инфаркт миокарда и др.); повышенный катаболизм белков (длительное голодание, кровотечения в ЖКТ, инфекции, канцерогенез, сахарный диабет и др.); снижение концентрации Cl-. Причины снижения концентрации мочевины в сыворотке крови: функциональная недостаточность печени (гепатит, цирроз, отравления мышьяком и др.); энзимопатии синтеза мочевины; повышенная скорость клубочковой фильтрации, обусловленная беременностью, чрезмерным объемом внутривенных инфузий, неадекватной секрецией антидиуретического гормона; мальабсорбция (целиакия). Влияющие факторы. Увеличение концентрации: диета с высоким содержанием белка, прием нефротоксичных лекарств, повышенный распад тканей при гипертиреозе, приеме глюкокортикоидов. Уменьшение концентрации:вегетарианская диета.
Определение концентрации мочевины в моче позволяет контролировать азотистый баланс у больных в тяжелом состоянии, получающих зондовое энтеральное и парентеральное питание. Корректно оценить азотистый баланс с использованием этого теста можно лишь при отсутствии тяжелой печеночной или почечной патологии. Увеличением концентрации мочевины в моче, указывающим на отрицательный азотистый баланс, сопровождаются: послеоперационный период, лихорадка; гипертиреоз; тяжелые острые или хронические соматические заболевания. Уменьшением, указывающим на положительный азотистый баланс, сопровождаются: беременность; период роста у детей; период восстановления после тяжелых заболеваний.
3. Обмен креатина. Синтез креатина, образование креатинфосфата и креатинина. Диагностическое значение определения креатина, креатинина и креатинкиназы.
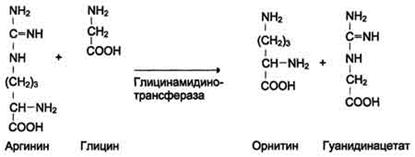
Синтез креатина. Креатин необходим для образования в мышцах высокоэнергетического соединения - креатинфосфата. Синтез креатина идёт в 2 стадии с участием 3-х аминокислот: аргинина, глицина и метионина. В почках образуется гуанидинацетат при действии глицинамидинотрансферазы.Затем гуанидинацетат транспортируется в печень, где происходит реакция его метилирования:
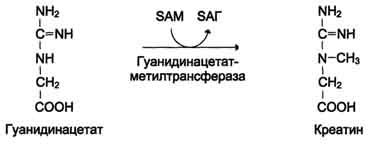
SAM – S-аденозилметионин – активная форма метионина – донор СН3-группы.
 Креатин с кровотоком переносится в мышцы и клетки мозга,где из него образуется высокоэнергетическое соединение - креатинфосфат.
Креатин с кровотоком переносится в мышцы и клетки мозга,где из него образуется высокоэнергетическое соединение - креатинфосфат.
 |
Эта реакция легко обратима и катализируется ферментом креатинкиназой. Обнаружено три изоферментные формы креатинкиназы (КК-ВВ – мозговой тип, КК-МВ – сердечный тип, КК-ММ – мышечный тип). Измерение активности общей креатинкиназы и ее изоферментов используется в лабораторной диагностике.
Креатинфосфат играет важную роль в обеспечении энергией работающей мышцы в начальный период.
Креатинин – это конечный продукт неферментативного превращения креатина и креатинфосфата, участвующих в энергообеспечении мышечного сокращения:

Креатинин выводится из организма через почки с мочой, относится к беспороговым веществам, которые поступают в мочу путем фильтрации и не реабсорбируются в канальцах. Нормы креатинина в сыворотке крови у взрослых: мужчины – 40-100 мкмоль/л, женщины – 44-88 мкмоль/л; креатинина в моче у взрослых - 4,4-17,7 ммоль/сут.
Клинико-диагностическое значение исследования концентрации креатина и креатинина в сыворотке крови и моче. Гиперкреатининемия – увеличение уровня креатинина в крови обусловлено как усиленным образованием, так и задержкой его в организме. Критическая концентрация креатинина в сыворотке крови: ˃400 мкмоль/л. Ретенционная гиперкреатининемия обусловлена нарушением (острым и хроническим) функции почек любого происхождения. Продукционная гиперкреатининемия отмечается при кишечной непроходимости, декомпенсации деятельности ССС, пневмонии, лихорадочных состояниях, гипертиреозе, голодании, усиленной мышечной работе. Снижение уровня креатинина в сыворотке крови коррелирует с уменьшением мышечной массы (мышечные дистрофии и атрофии, параличи и др.). Увеличение суточного выведения креатинина с мочой указывает на увеличение почечной фильтрации и/или повышенное образование креатинина в скелетных мышцах. Увеличением концентрации сопровождаются: усиленная мышечная работа, лихорадочные состояния, пневмония, акромегалия, сахарный диабет, острые инфекционные заболевания. Уменьшение выведения креатинина с мочой наблюдается при мышечной атрофии, параличах, хронических заболеваниях почек, острой почечной недостаточности, голодании. В моче помимо эндогенного креатинина содержится экзогенный креатинин, поступающий в организм с мясной пищей. На концентрацию креатинина в крови и моче влияет характер диеты: преимущественно мясная диета приводит к увеличению, и наоборот, вегетарианская диета – к снижению концентрации креатинина в крови и моче.
Креатинемия (креатин + греч. haima кровь) — наличие в крови креатина. В плазме взрослого человека концентрации креатина в норме составляет 15,25—76,25 мкмоль/л. Повышение уровня креатина в крови (гиперкреатинемия) может быть при избыточном употреблении мяса, а также при заболеваниях мышечной системы, при кишечной непроходимости. поражениях печени. Креатин в моче взрослых людей в норме практически отсутствует. В первые годы жизни ребенка возможна «физиологическая креатинурия». По-видимому, появление креатина в моче детей раннего возраста обусловлено усиленным синтезом креатина, опережающим развитие мускулатуры. Некоторые исследователи к физиологическим явлениям относят и креатинурию стариков, которая возникает как следствие атрофии мышц и неполного использования образующегося в печени креатина. При концентрации креатина в плазме крови свыше 122,0 мкмоль/л он начинает выделяться с мочой. Наибольшее содержание креатина в моче наблюдается при патологических состояниях мышечной системы и прежде всего при миопатии, или прогрессирующей мышечной дистрофии. Принято считать, что креатин в моче (креатинурия) больных миопатией может появляться в результате нарушения в скелетной мускулатуре процессов его фиксации (удержания) и фосфорилирования. Если нарушен процесс синтеза фосфокреатина, то не образуется и креатинин; содержание последнего в моче резко снижается. В результате креатинурии и нарушения синтеза креатинина резко повышается креатиновый показатель мочи: (количество креатина + количество креатинина)/(количество креатинина). В норме этот показатель близок к 1,1.
ТВОРЧЕСКАЯ РАБОТА СТУДЕНТОВ. Тема реферативного сообщения презентации «Энзимопатии цикла синтеза мочевины. Лабораторная диагностика гипераммониемии».






