Виконати лабораторні роботи:
1. Визначити рН різних розчинів за допомогою індикаторів.
2. Обчислення рН розчинів різних електролітів.
3. Приготувати ацетатний буферний розчин за заданим співвідношенням компонентів.
4. Вивчити властивості буферного розчину.
Методика виконання роботи
Робота 1. Приблизне визначення рН розчинів за допомогою індикаторів.
В три пробірки окремо налити по 1 мл води, розчинів кислоти і лугу. Дані розчини окремо випробувати універсальним індикатором, фенолфталеїном і метилоранжем, приливаючи в кожну пробірку по 2-3 краплі індикатора. Спостереження внести в таблицю, вказуючи зміну забарвлення індикатора.
| електроліти | індикатори | |||
| універсальний | фенолфталеїн | метилоранж | ||
| кисле | лужне | нейтральне | ||
Робота 2. Обчислення рН розчинів різних електролітів.
В чотири пробірки налити по 4,5 мл води і в кожну із них прилити по 0,5 мл 0,1н розчинів соляної, оцтової кислот, гідроксидів натрію і амонію. За допомогою універсального індикатора визначити рН кожного розчину. Теоретично обчислити концентрацію водневих іонів даних розчинів і їх значення звірити з практично визначеними. Дані оформити у вигляді таблиці:
| Електроліти | Сн | рН | |
| теоретичне | експериментальне | ||
| НСІ | |||
| СН3СООН | |||
| NaOH | |||
| NH4OH |
Записати висновки по кожній роботі.
Робота 3. Приготування ацетатного буферного розчину за заданим співвідношенням компонентів.
Кожна пара студентів готує 10 мл ацетатного буферу змішуючи 0,1 н розчини оцтової кислоти і ацетату натрію з вказаним викладачем співвідношенням (кислота:сіль=9:1;8:2; 7:3; 6:4; 5:5; 4:6; 3:7; 2:8; 1:9).
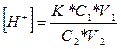
Концентрацію водневих іонів в буферному розчині визначають за формулою:
де К - константа дисоціації оцтової кислоти (1,8*10-5);
С1, V1, - об'єм і еквівалент розчину кислоти;
С2, V2 - еквівалент і об'єм розчину солі.
На основі знайденої концентрації водневих іонів буферного розчину вираховують рН за формулою:
рН = -lg [Н+].
Одержані дані занести в таблицю.
| №п/п | Vкислоти | Vсолі | [ H+ ] | рН |
За співвідношенням компонентів і рН буферних розчинів будують буферну криву в координатах рН®VK.
Робота 4. Властивості буферного розчину.
Необхідно перевірити, чи змінюється рН буферної суміші при доливанні кислоти або лугу (збільшенні концентрації), або доливанні води (зменшенні концентрації). Для цього в 4 пробірки налити по 2 мл приготовленого буферного розчину (роб.1). В першу пробірку прилити 2 кр 0,1М NaOH, в другу – 2 кр. 0,1 М НСІ, в третю – 2 кр. Н2О. Четверта пробірка служить еталоном. В кожну пробірку прилити по 2-3 кр індикатора метилоранжу. Що спостерігається? Записати рівняння відповідних реакцій.
Заняття 5






