Полифенолоксидаза(Н.Ф. 1.14.18.1). Этот фермент известен под различными тривиальными названиями: о-дифенолоксидаза, тирозиназа, фенолаза, катехолаза и др. Фермент может катализировать окисление моно-, ди-, и полифенолов.
Типичная реакция, катализируемая полифенолоксидазой, имеет вид:

Молекула фермента обладает четвертичной структурой и имеет молекулярную массу около 34 000 Да. Полифенолоксидаза — купропротеид. Содержание меди — 0,2%, или один атом Си на 1 молекулу фермента. Зона оптимальной активности лежит между рН 5,0 — 7,0.
В зависимости от того, из какого источника выделен фермент, способность его к окислению различных фенолов различна. Более того, даже в одном и том же объекте Полифенолоксидаза может содержаться в виде различных молекулярных форм, отличающихся по способности к окислению различных фенолов.
С действием этого фермента связано образование темноокрашенных соединений — меланинов при окислении кислородом воздуха аминокислоты — тирозина. Потемнение срезов картофеля, яблок, грибов, персиков и других растительных тканей в большей степени или полностью зависит от действия полифенолоксидазы. В пищевой промышленности основной интерес к этому ферменту сосредоточен на предотвращении рассмотренного нами ферментативного потемнения, которое имеет место при сушке плодов и овощей, а также при производстве макаронных изделий из муки с повышенной активностью полифенолоксидазы. Эта цель может быть достигнута путем тепловой инактивации фермента (бланшировка), добавлением ингибиторов (NaHSO3, SO2, NaCl) или связыванием субстрата посредством метилирования.
Положительная роль фермента проявляется при некоторых ферментативных процессах: например, при ферментации чая. Окисление дубильных веществ чая под действием полифенолоксидазы приводит к образованию темноокрашенных и ароматических соединений, которые определяют цвет и аромат черного чая.
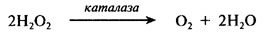
Каталаза (Н.Ф. 1.11.1.6). Этот фермент катализирует разложение пероксида водорода в соответствии со следующей реакцией:
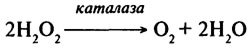
Таким образом, фермент окисляет одну молекулу перекиси водорода до кислорода с одновременным восстановлением другой молекулы перекиси водорода до Н2О.
Каталаза относится к группе гемопротеиновых ферментов. Содержит 0,009% железа в виде геминовой группировки или 4 атома на одну молекулу фермента. Молекулярная масса ферментов, выделенных из различных объектов (дрожжей, растительных и животных тканей, микроорганизмов), лежит в пределах от 225 000 до 250 000 Да. Они имеют существенные различия в оптимуме рН (от 2 до 9), в термо- и рН-стабильности. Фермент ингибируется цианидом (обратимо), фенолами (обратимо лишь в слабой форме), щелочью и мочевиной (необратимо). Функцией каталазы в живом организме является защита клетки от губительного действия перекиси водорода.
Хорошим источником для получения промышленных препаратов каталазы являются культуры микроорганизмов и печень крупного рогатого скота.
Каталаза находит свое применение в пищевой промышленности при удалении избытка Н2О2 при обработке молока в сыроделии, где последняя используется в качестве консерванта; а также совместно с глюкозооксидазой применяется для удаления кислорода и следов глюкозы.
Пероксидаза (Н.Ф. 1.11.1.7). Пероксидазы могут быть определены как ферменты, катализирующие следующую реакцию:
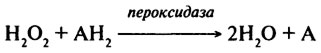
Пероксидаза — двухкомпонентный фермент, представляющий собой сочетание тема и гликопротеида. Показано, что углеводная часть придает белку большую специфичность; предполагают, что углеводы стабилизируют трехмерную структуру фермента.
В настоящее время выделено и охарактеризовано большое число множественных форм фермента и доказано существование изоферментов, то есть тех форм ферментов, которые обусловлены генетически. В связи с этим принято говорить о целой системе пероксидаз, работающих в любом живом организме. Интересным представляется факт широкой субстратной специфичности пероксидаз по отношению к донорам водорода (1 -и субстрат), ими могут служить фенолы, амины, другие органические соединения; и строгой специфичности по отношению к акцептору водорода (2-й субстрат) — перекиси водорода. Механизм реакции, предположительно, основан на образовании комплексов фермент — донор и двух одновалентных ступеней окисления, как это отражает следующая схема:
Пероксидаза + Н2О2 = Комплекс I
Комплекс I + АН2 = Комплекс II + АН
Комплекс II + АН = Пероксидаза + А
Изучению пероксидазы были посвящены классические работы Г. Теореля, Б. Чанса, А. Н. Баха, Р. Шода. Наиболее активная Пероксидаза выделена из корней хрена. Ее молекулярная масса равна примерно 40 000 Да, изоэлектрическая точка 7,2. Фермент содержит один атом железа на молекулу. Он достаточно устойчив в растворах при величинах рН от 4 до 12; его термостабильность значительно выше термостабильности каталазы. Оптимум рН для пероксидазы хрена равен 7; при рН от 6 до 8 сохраняется 70% его активности.
Липоксигеназа (Н.Ф.1.13.11.12). Этот фермент катализирует окисление полиненасыщенных высокомолекулярных жирных кислот (линолевой и линоленовой) кислородом воздуха с образованием высокотоксичных гидроперекисей. Ниже приведена реакция, катализируемая этим ферментом:
R....... СН2-СН=СН-СН2-СН=СН-СН2 ....... СООН
↓ + О2
R....... СН2-СН=СН-СН=СН-С(ООН)Н-СН2 ....... СООН
Возможно образование и циклических гидроперекисей по следующей схеме:
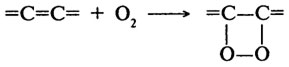
Однако основное количество жирных кислот превращаются в гидроперекиси, обладающие сильными окислительными свойствами, и именно на этом основано использование липоксигеназы в пищевой промышленности.
Липоксигеназа впервые была выделена из семян сои в 1928 г. Последующие исследования показали, что липоксигеназа широко распространена и в других растительных объектах: пшенице и других злаках, в семенах масличных и бобовых культур, в картофеле, баклажанах и т. д.
Тем не менее самым богатым источником фермента является мука соевых бобов. Липоксигеназа, полученная в кристаллическом состоянии из семян сои, имеет молекулярную массу 102 000 Да, изоэлектрическую точку 5,4. Оптимумы рН для ферментов, выделенных из различных объектов, сильно различаются. Оптимум температуры липоксигеназы находится между 20 и 30°С.
В зерне пшеницы активность липоксигеназы колеблется в значительных пределах и является сортовым признаком. Кроме того, активность липоксигеназы связана с показателем жизнеспособности зерна. Она закономерно снижается со снижением всхожести зерна и может быть биохимическим тестом жизнеспособности семян. Значительная часть липоксигеназы пшеницы прочно связана с клейковинными белками и освобождается при обработке клейковинного комплекса раствором восстановленного глутатиона.
Липоксигеназе принадлежит важная роль в процессах созревания пшеничной муки, связанных с улучшением ее хлебопекарных достоинств. Образующиеся под действием фермента продукты окисления жирных кислот способны вызывать сопряженное окисление ряда других компонентов муки (пигментов, SH-групп клейковинных белков, ферментов и др.). При этом происходит осветление муки, укрепление клейковины, снижение активности протеолитических ферментов и другие положительные изменения.
В разных странах разработаны и запатентованы способы улучшения качества хлеба, основанные на использовании препаратов липоксигеназы (главным образом, липоксигеназы соевой муки). Все они требуют очень точного дозирования фермента, так как даже небольшая передозировка приводит к резко отрицательному эффекту и вместо улучшения качества хлеба происходит его ухудшение.
Более мягкий способ воздействия на компоненты муки и теста связан с активацией собственной липоксигеназы муки путем некоторого варьирования технологического процесса. При этом исключается эффект передозировки фермента со всем комплексом нежелательных последствий.
Использование липоксигеназы как улучшителя окислительного действия требует определенной осторожности, так как хорошо известна токсичность переокисленных жиров. Интенсивное окисление липоксигеназой свободных жирных кислот может сопровождаться вторичными процессами образования веществ различной химической природы с неприятным вкусом и запахом, характерным для прогорклого продукта. Технологически приемлема ограниченная степень окисления полиненасыщенных жирных кислот как промежуточного звена преобразования других компонентов биологического материала, не приводящая к накоплению фракции окисленных липидов.
Глюкозооксидаза ( Н.Ф. 1.1.3.4). Этот фермент был впервые выделен еще в 1904 г. Н. А. Максимовым из плесневых грибов. Фермент представляет собой флавопротеид, в котором белок соединен с двумя молекулами ФАД. Он окисляет глюкозу с образованием в конечном счете глкжоновой кислоты и обладает практически абсолютной специфичностью по отношению к глюкозе. Суммарное уравнение имеет следующий вид:
Глюкоза + Н2О + О2 = глюконовая кислота + Н2О2
Представленный выше процесс на самом деле протекает в несколько стадий:
1-я стадия:
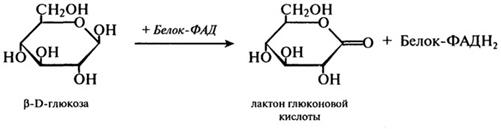
2-я стадия:
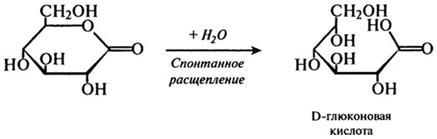
3-я стадия:
Белок-ФАД Н2 + О2 → Белок-ФАД + Н2О2
4-я стадия:
На первом этапе этой реакции происходит отнятие двух атомов водорода у первого углеродного атома глюкозы. При этом образуется восстановленный флавиновый фермент и лактон глюконовой кислоты. Далее восстановленный фермент реагирует с кислородом воздуха, и образуется перекись водорода. Токсичная перекись водорода расщепляется каталазой на кислород и воду, а β-О-глюконо-б-лактон подвергается спонтанному расщеплению с присоединением воды, в результате чего образуется глюконовая кислота.
Высокоочищенные препараты глюкозооксидазы получают из плесневых грибов рода Aspergillus и Penicillium. Они имеют примерно одинаковую молекулярную массу — около 150 000 Да, изоэлектрическую точку 4,2 — 4,3 и оптимум рН 5,6.
В последние годы глюкозооксидаза получила широкое применение. Благодаря исключительной специфичности препараты глюкозооксидазы применяются как аналитическое средство для количественного определения глюкозы.
Кроме этого, препараты глюкозооксидазы нашли применение в пищевой промышленности как для удаления следов глюкозы, так и для удаления следов кислорода. Первое — необходимо при обработке пищевых продуктов, качество и аромат которых ухудшаются из-за того, что в них содержатся восстанавливающие сахара; например, при получении из яиц сухого яичного порошка. Здесь имеется в виду реакция Майяра, т. к. глюкоза при сушке и хранении яичного порошка, особенно при повышенной температуре, легко вступает в реакцию с аминными группами аминокислот и белков. Порошок темнеет, и образуется ряд веществ с неприятным вкусом и запахом. Второе — необходимо при обработке продуктов, в которых длительное присутствие небольших количеств кислорода приводит к изменению аромата и цвета (пиво, вино, фруктовые соки, майонез). Внесение пакетиков, содержащих смесь воды, глюкозы, фермента и буфера, способствует удалению кислорода из воздушного пространства. Во всех подобных случаях в ферментную систему включают каталазу, разлагающую Н2О2, которая образуется при реакции глюкозы с кислородом. Этот метод нашел широкое применение в США для удаления кислорода из банок с сухим молочным порошком.






