Найефективніший спосіб знешкодження забруднених стічних вод хімічних підприємств – обробка їх речовинами, які осаджують шкідливі домішки у вигляді важкорозчинних сполук. При цьому важливо, щоб реагент-осадник був з надлишком, інакше необхідна степінь очищення стоків не буде досягнута. Підприємство подає на ділянку водоочищення стічну воду, яка містить 3,31 кг нітрату свинцю (ІІ). Осадження катіонів свинцю (ІІ) проводять, додаючи до розчину 1,27 кг карбонату натрію. Визначте, який реагент і в якій кількості знаходиться у надлишку. Розрахуйте також масу осадку карбонату свинцю (ІІ), який випадає.
Дано:
m(Pb(NO3)2) = 3,31 кг = 3 310 г
m(Na2CO3) = 1,27 кг = 1 270 г
M (Pb(NO3)2) = 331 
M(Na2CO3) = 106 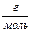
M (PbCO3) = 267 
n надл. -?
m (PbCO3) -?
Рішення:
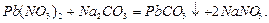 Запишемо рівняння реакції:
Запишемо рівняння реакції:
Для того щоб визначити, яка з речовин – нітрат свинцю (ІІ) або карбонат натрію – взято з надлишком, спочатку підрахуємо кількість кожної речовини:
n (Pb(NO3)2) = 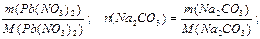
n (Pb(NO3)2) = 
n (Na2CO3) = 
Відповідно з коефіцієнтами рівняння реакції обидві речовини повинні бути взяті в однаковій кількості, але 12,0 моль > 10,0 моль, отже, карбонат натрій з надлишком, причому його надлишок складатиме:
nнадл. = 12,0 моль – 10,0 моль = 2,0 моль.
Розрахунок маси продукту ведемо за тим реагентом, який прореагував повністю, тобто за нітратом свинцю (ІІ):
n (PbCO3) = n(Pb(NO3)2) = 10,0 моль;
m (PbCO3) = n(PbCO3) · M(PbCO3);
m (PbCO3) = 10 · 267 
Відповідь: Надлишок Na2CO3 – 2,0 моль, маса осаду – 2,67 кг.






