Перш ніж вилити у каналізацію рідки відходи лабораторних робіт, які містять соляну кислоту, належить їх нейтралізувати лугом (наприклад, гідроксидом натрію) або кальцинованою содою (карбонатом натрію). Визначте маси гідроксиду і карбонату натрію, необхідних для нейтралізації відходів, які містять 0,46 моль HCl. Який об’єм газу (н.у.) виділиться при нейтралізації вказаної кількості відходів содою?
Дано:
n (HCl) = 0,46 моль
М (Na2CO3) = 106 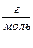
М (NaOH) = 40 
V m = 22,4 
m (NaOH) -?
m (Na2CO3) -?
V (СО2) -?
Рішення:
Запишемо рівняння реакції:
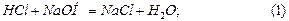
 .
.
Згідно рівнянь реакцій для нейтралізації заданої кількості HCl необхідно:

Для визначення об’єму вуглекислого газу, який виділився при нейтралізації сірчаної кислоти відповідно до рівняння реакції (2), додатково використовуємо рівняння, яке пов’язує між собою кількість газоподібної речовини, його об’єм і молярний об’єм:

Відповідь: необхідно 18 г NaOH або 24 г Na2CO3. Виділиться 5,2 л СО2.






