 |
по дисциплине Физическая химия
наименование учебной дисциплины
Выполнил
Студент, группы НМб-12-1 (подпись) А.В.Тищенко
(дата)
27.12.13
Принял
Преподаватель (подпись) Ф.М.Лебедь
(дата)
Иркутск –2013
1 Краткое теоретическое введение
В растворе электролита ток переносится катионами и анионами.
Т.к. с увеличением разведения величины степени диссоциации α и коэффициента электрической проводимости 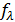 cтремящееся к единице, то эквивалентная электрическая проводимость при этом стремится к наибольшему значению
cтремящееся к единице, то эквивалентная электрическая проводимость при этом стремится к наибольшему значению  :
:
 (1)
(1)
где  - эквивалентная электрическая проводимость электролита при бесконечном разведении;
- эквивалентная электрическая проводимость электролита при бесконечном разведении;  - предельные подвижности ионов.
- предельные подвижности ионов.
Уравнение (1) называется законом Кольрауша, который устанавил, что в сильных электролитах можно наблюдать, например, следующую закономерность:
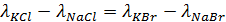 и т.п.
и т.п.
Т.е. физическая сущность этого закона состоит в том, что в разбавленных растворах электролитов катионы и анионы переносят электрический ток независимо друг от друга.
В растворах слабых электролитов, если концентрация ионов мала, межионные взаимодействия выражены гораздо меньше и можно считать 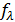 равное единице, тогда отношение эквивалентной электрической проводимости для раствора конечной концентрации к электрической проводимости при бесконечном разведении равно степени диссоциации, т.е.
равное единице, тогда отношение эквивалентной электрической проводимости для раствора конечной концентрации к электрической проводимости при бесконечном разведении равно степени диссоциации, т.е.
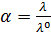 (2)
(2)
2 Расчетная часть
Примечание – В начале опыта измеряют удельную электрическую проводимость воды (ᴂH2O), которая равна 10*10-4
2.1 Раствор муравьиной кислоты
Изначально рассчитывается эквивалентная электрическая проводимость:
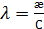 (3)
(3)
где  – удельная электрическая проводимость [См/м];
– удельная электрическая проводимость [См/м];
С – концентрация [моль/м3];
 – эквивалентная электрическая проводимость
– эквивалентная электрическая проводимость  .
.
Далее измеренные единицы будут переведены в единицы системы СИ


После чего по формуле (3) произвожу расчет для разных концентраций:




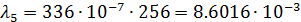


Рассчитаем степень диссоциации по формуле:
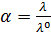 (4)
(4)
где  – степень диссоциации;
– степень диссоциации;
 (взято из табл.).
(взято из табл.).
Рассчитываем по формуле (4)  :
:






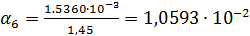
Константа диссоциации рассчитывается по формуле:
 (5)
(5)
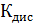 [моль/См*м2
[моль/См*м2 
По формуле (5) рассчитываем 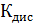 :
:



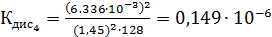



Среднее из всех вышеперечисленных значений будет равно  0,1469
0,1469  .
.
Таблица 1 – результаты измерений для муравьиной кислоты
| С (моль/литр) | ᴂ, ( ) )
| λ, ( ) )
| 
|  ( ( ) )
| 
|
| 1/16 | 1498·10-4 | 0,002397 | 0,001653 | 
|
0,1469 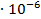
|
| 1/32 | 1058·10-4 | 0,003386 | 0,002335 | 
| |
| 1/64 | 728·10-4 | 0,004659 | 0,003213 | 
| |
| 1/128 | 495·10-4 | 0,006336 | 0,00437 | 
| |
| 1/256 | 336·10-4 | 0,008602 | 0,005932 | 
| |
| 1/512 | 231·10-4 | 0,011827 | 0,008157 | 
| |
| 1/1024 | 150·10-4 | 0,01536 | 0,010593 | 
|
2.2 Раствор уксусной кислоты
Аналогично предыдущему разделу, по формуле (3) рассчитывается эквивалентная электрическая проводимость. Затем рассчитывается степень диссоциации по формуле (4). Далее - константа диссоциации по формуле (5). Ввиду того, что выше пошагово был описан ход работы, конечные результаты приведены в таблице 2
Таблица 2 – результаты измерений для уксусной кислоты
| С (моль/литр) | ᴂ, (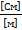 ) )
| λ, ( ) )
| 
|  ( ( ) )
| 
|
| 1/16 | 1028·10-4 | 0,001645 | 0,001134 | 
|
0,936 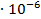
|
| 1/32 | 783·10-4 | 0,002506 | 0,001728 | 
| |
| 1/64 | 546,5·10-4 | 0,003498 | 0,002412 | 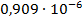
| |
| 1/128 | 400·10-4 | 0,00512 | 0,003531 | 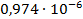
| |
| 1/256 | 278·10-4 | 0,007117 | 0,004908 | 
| |
| 1/512 | 202,65·10-4 | 0,010376 | 0,007156 | 
| |
| 1/1024 | 142,8·10-4 | 0,014623 | 0,010085 | 
|
3 Графическая часть
3.1 Муравьиная кислота

Рисунок 1 – Зависимость от разведения ᴂ, λ и α

Рисунок 2 - Зависимость lgλ – lgC

Рисунок 3 – Зависимость λ=sqrt(𝐶)
3.2 Уксусная кислота
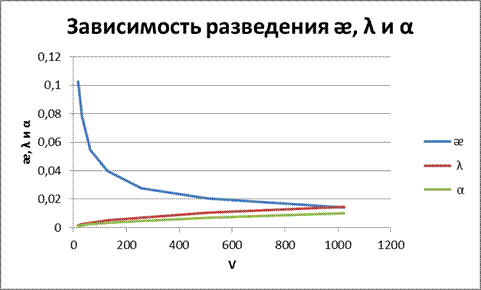
Рисунок 4 – Зависимость от разведения ᴂ, λ и α
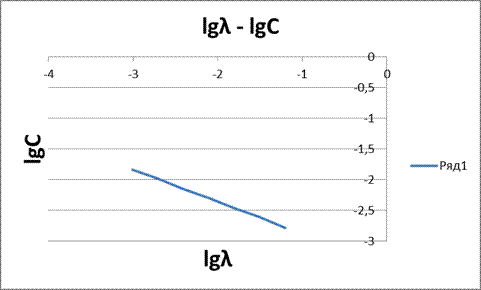
Рисунок 5 - Зависимость lgλ – lgC

Рисунок 6 – Зависимость λ=sqrt(𝐶)
Вывод
В ходе эксперимента была исследована зависимость удельной, эквивалентной, электрической проводимостей растворов слабого электролита. Было построено несколько графиков, демонстрирующих результаты проведенного опыта. Кроме того, была рассчитана константа диссоциации слабого электролита.






