Реакции, протекающие при пиролизе, можно разбить на две стадии. На первой происходят первичные реакции разложения компонентов сырья, имеющие радикально-цепной механизм. При этом образуются такие продукты, как водород, метан, этилен, этан и олефины с такой же, как у компонентов сырья, или более короткой углеродной цепью. На второй стадии протекают вторичные реакции с участием образовавшихся продуктов, имеющие более сложный механизм. При этом образуются такие продукты как диолефины, бензол, ацетилен, тяжелые смолы пиролиза, кокс.
Для пиролиза характерно глубокое разложение исходного сырья. При этом наряду с первичными реакциями распада, в результате которых образуются ненасыщенные углеводороды, протекают вторичные реакции изомеризации, циклизации, уплотнения продуктов первичного распада и другие. Протекание большого числа разнообразных реакций приводит к тому, что в процессе пиролиза образуется сложная смесь продуктов – от газообразных до твердых (кокс) [4].
Первичные реакции расщепления парафинов могут идти в двух направлениях:
разрыв цепи по связи С–С с образованием непредельного и предельного углеводородов, например:
СН3–СН2–СН3 → СН2=СН2 + СН4
и дегидрирование (разрыв связей С–Н):
СН3–СН2–СН3 → СН3–СН=СН2 + Н2
Первое направление термодинамически более вероятно, так как энергия разрыва связи С–С меньше, чем связи С–Н. Обе реакции идут с поглощением тепла и увеличением объема. Следовательно, им благоприятствуют высокие температуры и низкие давления.
Вторичные реакции, протекающие при пиролизе, весьма многочисленны: скелетная изомеризация парафинов и алкильных групп алкилароматических углеводородов, циклизация и дегидроциклизация олефинов с шестью и более атомами углерода, циклизация диенов, полимеризация олефинов и диенов, конденсация ароматических углеводородов и т.д.
Пиролиз протекает по радикально-цепному механизму. Доказательствами радикально-цепного механизма являются ускорение процесса инициаторами и торможение ингибиторами. Известно, что радикально-цепной процесс состоит из стадий инициирования, продолжения и обрыва цепи.
Рассмотрим механизм пиролиза парафинов на примере этана.
Инициирование цепи заключается в распаде молекулы этана по связи С–С на два метильных радикала:
1) СН3–СН3 ↔ 2СН3●
Далее идут передача цепи и её продолжение:
2) СН3● + СН3–СНЗ ↔ СН4 + СН3–СН2●
3) СН3–СН2● ↔ Н● + СН2=СН2
4) Н● + СН3–СН3 ↔ Н2+ СН3–СН2●
Обрыв цепи заключается в рекомбинации радикалов:
5) 2СН3● ↔ С2Н6
6) СН3● + СН3–СН2● ↔ С3Н8
7) 2СН3–СН2● ↔ С4Н10
Реакции (1)–(7) описывают образование основных продуктов распада этана на начальных стадиях пиролиза. Основными продуктами пиролиза этана являются водород, этилен и метан. Для пиролиза этана характерно, что цепь распада ведет радикал Н●, а радикал СН3● образуется в очень небольших количествах только на стадии инициирования.
В случае пиролиза пропана на стадии продолжения цепи большую роль играют как радикал Н●, так и метильный радикал СН3●.
Инициирование цепи:
1) СН3–СН2–СН3 ↔ СН3● + СН3–СН2●
Реинициирование, заключающееся в быстром распаде этильного радикала:
2) СН3–СН2● ↔ Н● + СН2=СН2
|
н-пропильный радикалы:
 |
 3) СН3● + СН3–СН2–СН3
3) СН3● + СН3–СН2–СН3
| |||
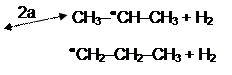 |
 4) Н● + СН3–СН2–СН3
4) Н● + СН3–СН2–СН3
|
5) С2Н5● + С3Н8 ↔ С2Н6 + С3Н7●
6) СН3–●СН–СН3 ↔ СН3–СН=СН2 + Н●
7) ●СН2–СН2–СН3 ↔ СН2=СН2 + СН3●
Радикалы Н● и СН3● ведут цепь распада дальше. Обрыв цепи протекает по реакциям:
8) 2СН3● ↔ С2Н6
9) СН3● + С2Н5● ↔ С3Н8
10) 2С2Н5● ↔ С4Н10
Приведенный механизм распада пропана соответствует составу продуктов только на начальных стадиях процесса: большое влияние на состав продуктов пиролиза оказывает температура. При низких температурах, соответствующих процессу крекинга, проявляется большая роль реакций (1а) и (2а) по сравнению с (1б) и (2б), так как энергия разрыва связи С–Н у первичного углеводородного атома больше, чем у вторичного.






